長年にわたり多くの男性に使用されてきた脱毛治療薬「フィナステリド」が、深刻な精神的副作用や自殺リスクの上昇と関連していることが、イスラエルのハダサ=ヘブライ大学医学センターによる新たな研究で明らかになりました。
薬剤の副作用については、製薬業界や規制当局が十分な検証を行ってこなかった可能性があり、研究者たちはこの問題を「薬剤監視の体系的な失敗」と指摘しています。
以下に研究の内容をまとめます。
参考記事)
・Decades of Studies Link Suicide Risk With Common Hair Loss Treatment(2025/10/14)
参考研究)
・Failing Public Health Again? Analytical Review of Depression and Suicidality From Finasteride(2025/09/22)
20年以上続く議論の焦点:フィナステリドとは何か
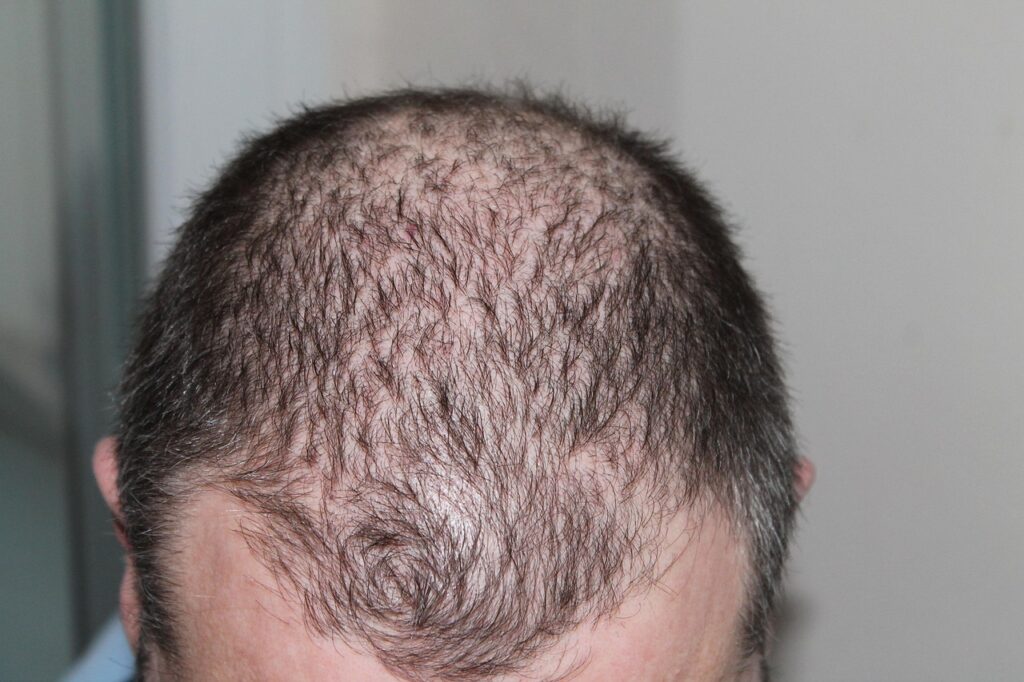
フィナステリドは1990年代以降、男性型脱毛症や前立腺肥大(良性前立腺過形成)の治療薬として広く処方されてきました。
世界中で数百万人の男性が使用しており、特に薄毛治療薬として知られるプロペシアの成分として有名です。
この薬は、男性ホルモンであるテストステロンがジヒドロテストステロン(DHT)に変換されるのを抑制することで、脱毛を防ぐ仕組みです。
しかし同時に、脳内で合成されるステロイド(アロプレグナノロンなど)の生成も抑制することが分かっており、これらの物質は情動の安定や不安の軽減に関与しています。
用語)
・アロプレグナノロン
女性ホルモンの一種であるプロゲステロンの代謝産物
脳内の鎮静や抗不安作用に関与すると考えられている
脳内で主要な抑制性神経伝達物質であるGABA(ギャバ)の働きを高めることで、リラックス効果や眠気を誘発する
そのため近年、フィナステリドが気分障害や自殺念慮を引き起こす可能性について、世界中の研究者が警鐘を鳴らしてきました。
精神的副作用の証拠はすでに「逸話」ではない
今回の研究を主導したのは、Mayer Brezis教授(ハダサ=ヘブライ大学医学センターの腎臓学者)で、彼は、2017年から2023年に発表された8件の研究を分析し、複数の国やデータベースを横断してフィナステリド使用者の精神的健康リスクを調べました。
その結果、フィナステリドを服用した人々は、服用していない人に比べてうつ病や不安障害、自殺念慮の発生率が有意に高いことが示唆されました。
Brezis教授は次のように述べています。
「もはやこれは単なる逸話ではない。異なる人種や文化圏をまたいで一貫したパターンが見られる。そしてその結果は、悲劇的なものとなっている可能性がある。」
FDAの遅れた対応と内部文書の存在
アメリカ食品医薬品局(FDA)は、2011年に「うつ病」をフィナステリドの副作用として警告表示に追加し、さらに2022年には「自殺念慮」を追加しました。
しかし実際には、2002年の時点ですでに研究者たちはその危険性を指摘していたといいます。
さらにBrezis教授の報告によると、FDA内部の専門家は2010年の段階で「自殺念慮および自殺行動」を警告ラベルに追加すべきと提案していたにもかかわらず、その意見は却下され、議論の詳細や判断理由は非公開とされました。
Brezis教授は、FDAの内部文書の一部が「機密」として黒塗りされており、影響を受ける可能性のある人数の推定値までも隠されていたと指摘しています。
彼は論文の中で次のように強調しています。
「イノベーションと安全性、進歩と公衆衛生の間に本質的な対立があるときこそ、透明性が極めて重要である。」
報告された自殺者はわずか18人──しかし実際は数千人規模か
FDAの公式記録によると、2011年までにフィナステリド使用と関連する自殺例は18件にとどまっていました。
しかし、世界的な使用人口を考慮すると、Brezis教授の推定では実際の関連自殺数は数千人規模に上る可能性があるといいます。
これは単なる「報告不足」ではなく、薬剤監視(ファーマコビジランス)の体系的な崩壊だと彼は主張しています。
Brezis教授は、フィナステリドの製造元であるメルク社(Merck)にも責任があると指摘します。
メルク社はデータベース分析による安全性研究など、簡易な調査すら行っていなかったとされ、規制当局もその実施を求めなかったといいます。
一方でメルク社は、2021年にロイター通信へ次のような声明を発表しています。
「科学的証拠はプロペシア(フィナステリド)と自殺または自殺念慮の間に因果関係を示しておらず、これらの用語をラベルに含めるべきではない。」
また同社は、「当社は規制当局と連携しながら安全性に関するシグナルを継続的に評価し、必要に応じてラベルに反映している」とも述べています。
しかし、今回のレビューに含まれた8件の研究のいずれもメルク社や規制機関によって実施されたものではないことが判明しており、薬の「化粧品扱い」による監視の甘さが背景にある可能性も指摘されています。
脳への長期的影響──神経ステロイドの抑制と構造変化
フィナステリドはDHT生成を抑える一方で、情動の調整に関わる神経ステロイド(脳内で合成されるステロイド)の生成も妨げます。
動物実験では、脳の炎症反応や海馬(記憶や感情に関わる脳構造)の構造変化が観察されており、長期的な影響が懸念されています。
さらに、一部の患者では薬の服用を中止した後も数カ月から数年にわたり精神症状が持続する「ポスト・フィナステリド症候群(post-finasteride syndrome)」と呼ばれる状態が報告されています。
金銭的利害が安全性を覆い隠す構造
Brezis教授は、経済的利益が安全性の懸念を押しのけてしまうという問題を強調しています。
これは過去にも繰り返されてきた構図であり、今回のフィナステリド問題も例外ではないといいます。
製薬企業が市場拡大を優先し、規制当局が十分な監視を行わないことで、結果的に患者が過剰なリスクにさらされる構造的問題が存在すると指摘しています。
「承認後の安全性研究」を義務化すべきだと提言

今回の研究は「薬剤の安全性が明確に確認されない限り、承認すべきではない」という結論で締めくくられています。
さらに、承認後も継続的な安全性の調査を法的義務として課す必要があると主張しています。
Brezis教授は次のように訴えます。
「薬が市場に出る前に、製薬企業が承認後の解析研究を実施・公開することを約束させ、その義務が確実に履行されるよう規制当局は監視すべきです。」
結論と今後の課題
今回の研究は、長年にわたって見過ごされてきた薬剤のリスクを改めて浮き彫りにしました。
髪の毛という見た目の問題を解消するための薬が、精神的健康を損なう可能性があるという事実は、医療の在り方を根本から問うものです。
Brezis教授の指摘がすべての症例に当てはまるかどうかは、今後の研究でさらに精査される必要がありますが、「薬の安全性を信頼する」ことがどれほど危ういかを私たちに突きつけています。
まとめ
・フィナステリド使用者は、うつ病や自殺念慮のリスクが高い可能性がある
・FDAや製薬企業による警告表示の遅れ・情報非公開が問題視されている
・薬剤承認後の安全性研究を法的に義務づける必要性が指摘されている


















コメント