炎症性腸疾患(IBD)を長年抱える人では、大腸がんの発症リスクが顕著に高まることが知られています。
しかし、慢性的な腸の炎症が、どのような仕組みでがんへとつながっていくのか、その分子レベルの詳細は十分に解明されていませんでした。
今回、腸内の免疫シグナルと骨髄を結ぶ新たな経路が、腫瘍形成を強力に後押ししている可能性を示す研究成果が報告されました。
以下に研究の内容をまとめます。
参考記事)
・Why chronic gut inflammation can turn into colon cancer(2026/01/25)
参考研究)
研究の中心となった炎症シグナル「TL1A」

この研究の焦点となったのは、TL1A(TNF-like ligand 1A)と呼ばれる炎症性シグナルタンパク質です。
TL1Aは、これまでの研究から、炎症性腸疾患(IBD)と大腸がんの両方に関連することが知られていました。
実際に、TL1Aの働きを阻害する薬剤は、IBD治療の臨床試験において良好な成績を示しています。
しかし、TL1Aがどの細胞に作用し、どのような経路を通じて炎症やがんの進行を促しているのかについては、長らく不明な点が残されていました。
本研究を主導したのは、ワイル・コーネル医学大学(Weill Cornell Medicine)の研究チームです。
主任研究者は、同大学で炎症性腸疾患研究の中核を担うRandy Longman氏は、本研究について次のように述べています。
「TL1AがIBDにおいて果たす役割、そしてIBDに関連する大腸がんとの関係を理解することは、医療界において極めて重要な課題である。これまで、がんリスクを軽減するための有効な戦略はほとんど存在しなかったが、本研究はその糸口を示している。」
IBDとがんリスク
IBDは、クローン病と潰瘍性大腸炎を含む疾患群で、消化管に慢性的な炎症が生じることを特徴とします。
米国疾病予防管理センター(CDC)によると、アメリカ国内では約240万〜310万人がIBDを患っているとされています。
日本における2023年時点での統計では、潰瘍性大腸炎の推定患者数は約316,900人、クローン病の推定患者数は 約95,700人です。(Nationwide estimates of patient numbers and prevalence rates of ulcerative colitis and Crohn’s disease in Japan in 2023より)
これは2015年の前回調査と比較して、両疾患とも約1.4倍に増加している推計になります。
IBDは、下痢や腹痛といった消化器症状にとどまらず、他の自己免疫疾患や炎症性疾患のリスクを高めることが知られています。
中でも深刻なのが、大腸がんの発症リスクが大幅に上昇する点です。
IBD患者において発症する大腸がんは、比較的若年で見つかることが多く、予後も不良になりやすいという特徴があります。
TL1Aが作用する「ILC3」という免疫細胞
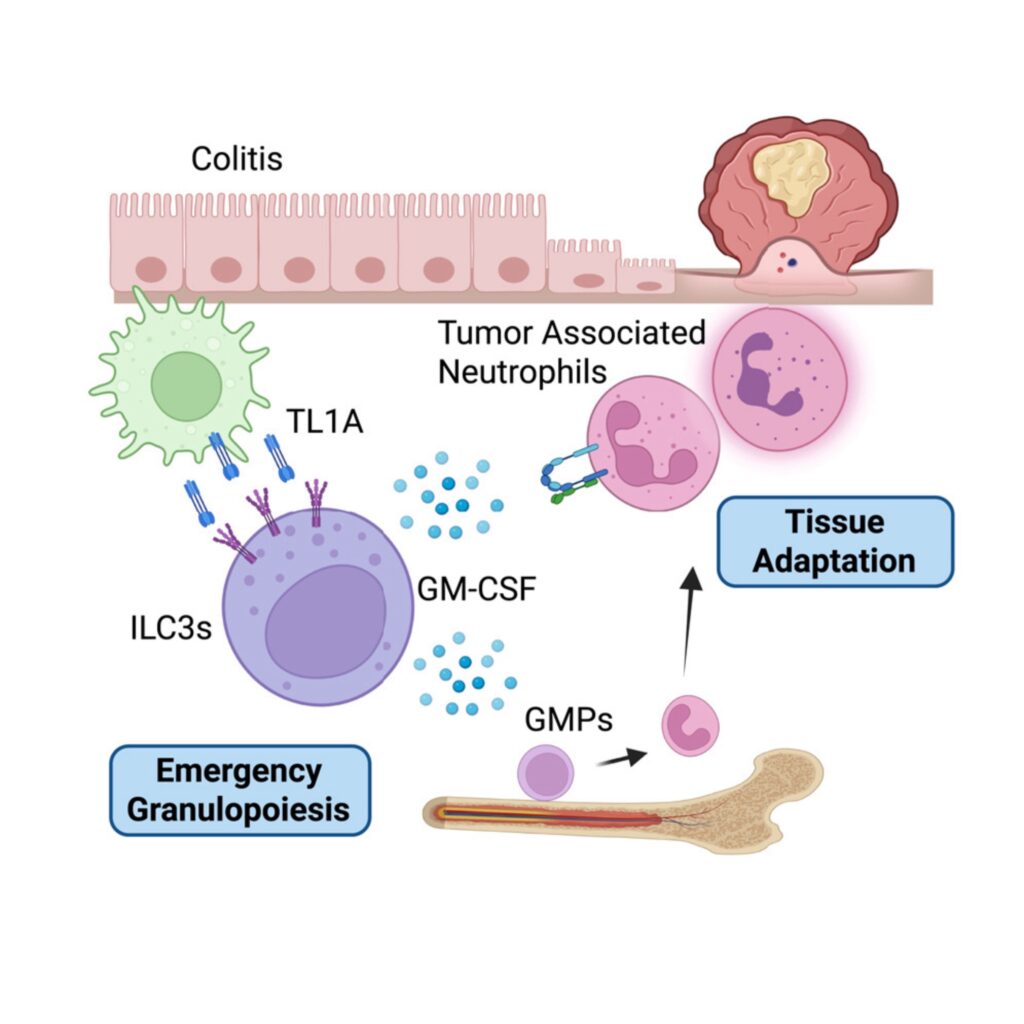
研究チームは、TL1Aが腫瘍形成を促進する主な経路として、ILC3(第3群自然リンパ球)と呼ばれる免疫細胞に注目しました。
ILC3は腸管に常在する免疫細胞で、通常は腸内環境の維持や病原体防御に関与しています。
今回の研究では、炎症を起こした腸内で産生されるTL1AがILC3を活性化することが示されました。
活性化されたILC3は、GM-CSF(顆粒球・マクロファージコロニー刺激因子)という物質を放出します。
骨髄を巻き込む「緊急顆粒球増殖」
GM-CSFは、骨髄における血球産生を強力に刺激する因子です。
このシグナルを受け取った骨髄では、「緊急顆粒球増殖(emergency granulopoiesis)」と呼ばれる現象が起こります。
これは、通常よりもはるかに速いペースで好中球が大量生産される状態を指します。
その後、増加した好中球は血流に乗って腸管へと移動し、炎症部位に集積します。
マウスを用いた腸管がんモデルでは、この好中球の存在だけで腫瘍の発生と成長が加速されることが確認されました。
好中球が腫瘍を促進する仕組み
好中球は本来、感染防御に不可欠な白血球ですが、大腸がんにおいては腫瘍促進的な役割を果たすことが知られています。
好中球は、活性酸素種などの反応性分子を放出し、腸上皮細胞のDNAに損傷を与えることで、がん化を助長します。
今回の研究では、それに加えて、ILC3によって動員された好中球が、特異的ながん促進型の遺伝子発現パターンを示すことが明らかになりました。
この遺伝子群には、がんの発生や進行に関与する遺伝子の活性上昇が含まれていました。
ヒトIBD患者でも確認された同様の変化
研究チームは、IBD関連大腸炎を持つ患者の大腸組織サンプルも解析しました。
その結果、マウスモデルで観察された好中球の遺伝子発現変化と非常によく似たパターンが、ヒトの腸組織でも確認されました。
さらに注目すべき点として、TL1Aを阻害する実験的治療を受けた患者では、この腫瘍促進型の遺伝子シグネチャーが弱まっていたことが示されています。
ただし、この治療が長期的に大腸がん発症リスクを低下させるかどうかについては、現時点ではまだ確定していません。
本研究の成果は、IBD治療と大腸がん予防の両面において、新たな治療標的の候補を提示しています。
具体的には、TL1Aそのもの、ILC3細胞、GM-CSF、ILC3によって動員される好中球といった複数の要素が、将来的な介入ポイントになり得ると考えられています。
今後の研究課題と残された不確実性
研究チームは現在、腸の炎症時にこの免疫ネットワークがどのように機能しているのか、さらに詳細な解析を進めています。
特に、GM-CSFへの一過性あるいは早期の曝露が、骨髄細胞を長期的に変化させ、将来的なIBD感受性を高める可能性についても検討が続けられています。
ただし、本研究の多くの知見はマウスモデルに基づいており、ヒトにおいて同じメカニズムが完全に再現されるかどうかは、今後の長期的・大規模研究を待つ必要があります。
また、TL1A阻害が実際に大腸がん予防につながるかどうかについても、現時点では確定的な結論は出ていない点については、今後の研究に期待がもたれます。
まとめ
・TL1AはILC3を介して好中球を動員し、慢性炎症を大腸がんへとつなぐ免疫経路を形成している可能性が示された
・IBD患者の腸組織でも、腫瘍促進型の免疫変化が確認されたが、因果関係の完全な証明にはさらなる研究が必要
・TL1Aや関連免疫細胞は、将来のIBD治療と大腸がん予防の新たな標的となる可能性がある
















コメント