2025年、ノーベル生理学・医学賞が、「体が自らの免疫システムを暴走させずに制御する仕組みを発見した」三人の科学者に授与されました。
受賞者は、大阪大学の坂口志文(Shimon Sakaguchi)氏、そしてアメリカのシステム・バイオロジー研究機構に所属するMary E. Brunkow氏、さらにSonoma BiotherapeuticsのFred Ramsdell氏の三名です。
彼らは、免疫システムの働きを監視する「制御性T細胞(regulatory T cells)」という特殊な細胞群を発見し、自己免疫疾患の理解と治療の基礎を築いたことで知られていました。
この度の受賞は、彼らの免疫学に与えた影響および、制御性T細胞と免疫システムに対する発見が高く評価されたものです。
本記事では、この発見の何が画期的なのかと、発見された仕組みついて詳しくまとめていきます。
参考記事)
・Nobel prize awarded for discovery of immune system’s ‘security guards(2025/10/07)
・They understood how the immune system is kept in check(2025/10/07)
免疫システムの二面性 ― 攻撃と制御の絶妙なバランス
免疫システムの大原則は自他認識です。
細胞の成長過程で組織を形作り、老廃した細胞や不要な残骸を除去し、ウイルスや細菌、真菌などの外敵を排除します。
その一方で、自らの組織を「敵」と誤認してしまうことがあります。
誤認によって、もし特定の膵臓組織を攻撃してしまうと、インスリンのコントロールができずに一型糖尿病に、もし関節の滑膜や軟骨組織を攻撃してしまうと関節リウマチに……。
といったように、免疫反応が暴走することによって自分の体を攻撃してしまう危険性があります。
免疫学者たちは長年にわたり、「免疫システムはいかにして自己と非自己を識別するのか」という問いに取り組んできました。
この複雑な仕組みの中心的な謎を解き明かしたのが、坂口氏らです。
彼らの発見によって、免疫システムを抑制し、自己攻撃を防ぐ役割を担う特別な細胞 (制御性T細胞:T-regs)の存在が明らかにされたのです。
自己免疫疾患と胸腺の謎
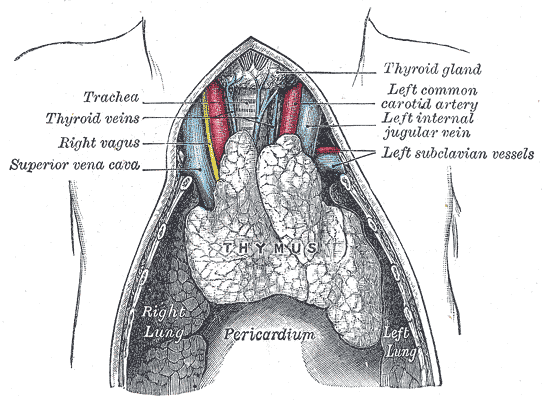
免疫システムの中には、Tリンパ球と呼ばれる免疫細胞が存在します。
これらの細胞は、体内の異物を見分け、排除する中心的な役割を果たす一方で、誤作動が起これば自己組織を攻撃し、一型糖尿病、関節リウマチ、多発性硬化症といった自己免疫疾患を引き起こします。
この仕組みに対してかつて科学者たちは、胸腺(thymus)という胸部の小さな臓器が免疫寛容を司ると信じていました。
胸腺の中で、自己のタンパク質に強く反応するT細胞は排除され、軽度な反応しか示さない細胞だけが体内に放出されると考えられていたのです。
つまり、胸腺によって免疫のバランスが保たれているとされていました。
しかし、坂口氏は1980年代から1990年代に行った研究は、この常識を覆すものでした。
「制御性T細胞」という新たな概念を生んだ坂口氏の研究
坂口氏は、新生マウスから胸腺を外科的に摘出し、遺伝的に同一のマウスからT細胞を注入するという実験を行いました。
彼の仮説では、この処置によってマウスの免疫システムが弱まり、T細胞の数が減ると予想されていました。
ところが、実際の結果はまったく逆でした。
マウスには、むしろ自己免疫疾患の発症を防ぐT細胞が別に存在することが示唆されました。
この予想外の結果が、のちに「制御性T細胞」という概念へとつながる最初の手がかりとなりました。
坂口氏はその後10年以上にわたり、免疫応答を抑える働きをもつT細胞の存在を追究しました。
そして1995年に発表された論文で、ついに「制御性T細胞(regulatory T cell)」という新たな免疫細胞の存在を明確に示しました。
この細胞は、特定のタンパク質を表面に持ち、他の過剰に反応するT細胞を抑制する働きを持つことが確認されたのです。
参考)
・Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseasesまたは制御性 T 細胞と自己免疫疾患
FoxP3という決定的マーカーの発見
当初、科学界では「制御性T細胞」という概念に懐疑的な見方もありました。
しかし、アメリカのMary E. Brunkow氏とFred Ramsdell氏の研究が、この理論を強固に裏付けることになります。
彼らは1990年代から2000年代初頭にかけて、制御性T細胞がどのように免疫応答を抑えるのかを詳細に明らかにしました。
Brunkow氏とRamsdell氏の研究によると、T-regsは免疫反応を鎮めるタンパク質を分泌するほか、他の免疫細胞に直接的な抗炎症シグナルを送ることで、過剰な炎症反応を防いでいることが分かりました。
さらに彼らは、T-regsを特徴づける特定のタンパク質であるFoxP3を発見しました。
このFoxP3は、制御性T細胞を他のT細胞と区別する「指紋」のような役割を果たし、研究者たちは初めてこれらの細胞を同定・分離して研究できるようになったのです。
この成果によって、制御性T細胞が免疫バランスの維持において中心的な役割を果たしていることが確立されました。
免疫学における炎症制御と治療への応用
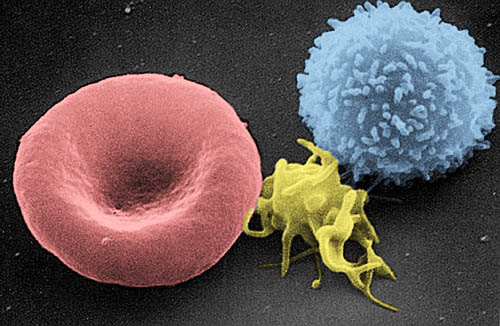
今回のノーベル賞受賞者たちの研究は、単なる免疫寛容の理解にとどまりません。
免疫と炎症のプロセスが、静的ではなく動的に制御されているという新たな視点をもたらしました。
これにより、感染症やアレルギー、環境汚染物質による炎症、自己免疫疾患といった多様な疾患に対して、新しい治療戦略が提案されるようになりました。
また、臓器移植における拒絶反応の予防や、がん免疫療法・ワクチンの効果を高める新しいアプローチにもつながる可能性が示されています。
現在では、制御性T細胞を活用した新しい免疫療法の開発が進められていますが、これらの細胞がどのようにして環境刺激や代謝状態、老化などの影響を受けるのかについては、まだ完全には理解されていません。
また、T-regsの過剰な活性化ががんの免疫回避に関与している可能性も指摘されており、今後の研究が求められています。
したがって、この分野の研究は今後も「免疫のバランス」をいかに最適化するかという中心課題のもとで、基礎科学から臨床応用まで幅広く発展していくと考えられます。
まとめ
・大阪大学の坂口志文氏らの研究により、自己免疫を防ぐ「制御性T細胞(T-regs)」に関するメカニズムが明らかになった
・Brunkow氏とRamsdell氏が、この細胞を特定するタンパク質「FoxP3」を発見し、免疫制御の分子メカニズムを解明した
・この発見は、自己免疫疾患、臓器移植、がん免疫療法など、現代医療の多くの分野に応用可能な新しい道を開くことが期待される

















コメント