長年にわたり、過度のアルコール摂取が肝臓に深刻な障害を引き起こすことは広く知られてきました。
最新の研究により、これまで十分に理解されていなかった「悪循環」の存在が明らかになりました。
慢性的なアルコール摂取は、腸から細菌が漏れ出して肝臓に移動しやすくする仕組みを助長し、結果として肝障害をさらに悪化させることがわかったのです。
今回のテーマとして、以下に研究の内容をまとめます。
参考記事)
・Vicious Cycle Revealed: How Alcohol Helps Gut Bacteria Attack Your Liver(2025/09/04)
参考研究)
・mAChR4 suppresses liver disease via GAP-induced antimicrobial immunity(2025/08/20)
研究の背景と目的
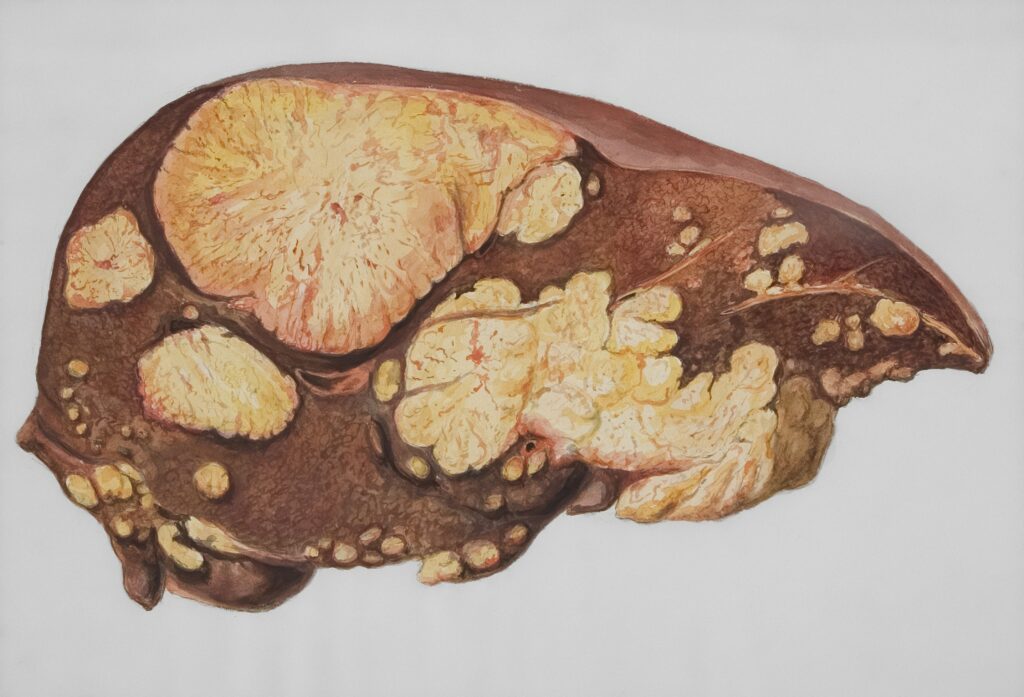
アルコール関連肝疾患(Alcohol-associated liver disease, ALD)は、世界的に深刻な健康問題です。
アルコールは社会生活において広く消費されている嗜好品である一方で、その過剰摂取は肝硬変、肝がん、さらには多臓器障害の主要な要因となっています。
従来の研究では、アルコールの代謝によるアセトアルデヒドの毒性や酸化ストレスが主な原因とされてきましたが、近年は「腸と肝臓をつなぐ腸肝軸」という視点が注目されています。
今回の研究では、アルコールが腸内環境と免疫応答をどのように変化させ、それが肝障害につながるのかという新たなメカニズムに迫るものです。
世界的な疫学データから見るアルコール関連肝疾患
アルコール関連肝疾患の影響は、先進国・途上国を問わず世界中で深刻化しています。
世界保健機関(WHO)の報告によると、全世界の肝硬変死亡の約50%がアルコールに関連しているとされています。(Global burden of alcoholic liver diseasesより)
これは毎年およそ50万人以上の死因に直結している数字です。
ヨーロッパではアルコール関連肝疾患が肝移植の主要原因となっており、全体の40%近くを占める国もあり、特に東ヨーロッパ諸国では飲酒習慣が強く、死亡率が高い傾向にあります。
また、アジア地域では経済発展に伴う飲酒量の増加が新たな課題です。
従来はウイルス性肝炎が肝疾患の中心でしたが、近年はアルコール性肝疾患の割合が増加しています。
日本においても、アルコール性肝硬変は肝移植の大きな要因となりつつあります。(アルコールと肝疾患―病態と疫学―より)
このように、アルコール関連肝疾患は地域によって背景に違いがあるものの、「飲酒習慣の広がり → 慢性的な肝障害 → 高い死亡率」という流れは世界共通の問題です。
研究の中心と方法
今回の研究は、カリフォルニア大学サンディエゴ校 の科学者チームによって行われました。
研究では、ヒトの肝臓生検サンプルに加えて、マウスを用いた動物モデルを組み合わせることで、アルコール関連肝疾患の進行に関わる仕組みを解明しようとしました。
注目されたのは、小腸で作られるシグナル伝達タンパク質mAChR4(ムスカリン性アセチルコリン受容体4型:M4受容体)です。
【用語】
・ムスカリン受容体(muscarinic acetylcholine receptor, mAChR)
副交感神経系の主要なアセチルコリン受容体で、M1〜M5の5種類のサブタイプが知られている
・M1受容体:中枢神経系(大脳皮質、海馬)に分布
胃腺 神経興奮促進、記憶・学習促進、胃酸分泌促進
・M2受容体 :心臓(洞房結節、房室結節)に分布
中枢神経系 心拍数低下、神経伝達抑制
・M3受容体:平滑筋(気管支、消化管、膀胱)に分布
外分泌腺、眼(瞳孔括約筋) 平滑筋収縮、腺分泌促進、縮瞳
・M4受容体:中枢神経系(線条体など)に分布
ドーパミン放出抑制、運動制御
・M5受容体:中枢神経系(黒質、血管内皮)に分布
脳血流調節、ドーパミン放出促進
このタンパク質は脳内で習慣や依存の形成に関与することが知られていますが、腸内でも重要な役割を果たすことが分かりました。
mAChR4と腸の防御機構
研究チームは、慢性的なアルコール摂取が小腸における mAChR4の産生を阻害する ことを突き止めました。
このタンパク質が減少すると、Goblet cell-associated antigen passages(GAPs)と呼ばれる特殊な構造の形成が妨げられます。
【用語】
・GAPs
杯細胞が粘膜の外の物質を細胞内に取り込み、粘膜深部の細胞に受け渡す仕組み(順天堂大学 結膜が素早く能動的にアレルゲンを取り込む仕組みを解明 より)
腸や結膜などの粘膜組織で確認されており、その役割は部位によって異なる
また、GAPsは腸内細菌が腸管を超えて他の臓器へ移動する際、免疫系がその状況を適切に認識し、過剰な炎症を防くために不可欠です。
防御システムへ伝達役であるGAPsが十分に形成されなければ、腸内細菌が肝臓に侵入しやすくなり、アルコールが引き起こす炎症や障害が悪化するのです。
研究の結果では、mAChR4低下 → GAPs形成不全 → 細菌侵入 → 肝障害悪化 という悪循環が存在することが明らかになりました。
免疫機構の修復と新しい治療の可能性
研究者たちは、mAChR4の機能を回復させると、この悪循環を断ち切れることを突き止めました。
マウスの実験では、mAChR4を活性化させると再びGAPsが形成され、免疫応答が回復し、肝臓の炎症が抑えられました。
その手法は次の二つです。
1. 薬剤によって直接mAChR4を活性化する方法
2. 関連経路を標的とし、間接的にmAChR4を高める方法
これらは新しい治療戦略となる可能性があり、従来「飲酒をやめる以外に確実な予防法がない」とされてきたアルコール関連肝疾患に対して希望を与える成果です。
アルコール依存症との関連

さらに重要なのは、mAChR4が脳内の依存形成にも関わっている点です。
アルコール使用障害(AUD)の患者では、脳内のmAChR4レベルが低下していることが知られています。
現在、mAChR4を高める薬剤は統合失調症の臨床試験で使用されており、今後アルコール依存症の治療薬として応用できる可能性があります。
これは、肝疾患と依存症という二つの問題を同時に解決するアプローチになり得ます。
研究の意義と今後の課題
この研究は、アルコール関連肝疾患が「肝臓だけの問題」ではなく、腸内環境と免疫系を介した全身的な病態であることを示した点で画期的です。
ただし、今回の成果はマウス実験が中心であり、ヒトでの大規模臨床試験は未実施な点には注意が必要です。
また、mAChR4を標的とした薬剤が安全かつ有効であるかは今後の研究次第であり、アルコール依存症におけるmAChR4の働きについても不明点が残されています。
したがって、この研究成果をそのまま臨床に適用するのは時期尚早ですが、治療法の可能性を大きく広げた意義は非常に大きいといえます。
まとめ
・世界的にアルコール関連肝疾患は肝硬変死亡の約半数を占め、死亡率上昇が深刻化している
・慢性的な飲酒は小腸でのmAChR4産生を阻害し、GAPs形成を妨げることで腸内細菌が肝臓へ侵入しやすくなり、肝障害を悪化させる
・mAChR4の活性化によって免疫応答が回復し、将来的には肝疾患とアルコール依存症の両方の治療に役立つ可能性がある


















コメント