硫黄
硫黄といえば、温泉地でよく嗅ぐあの臭いで有名ですね。
山を登れば、ところどころにある蒸気孔周辺に黄色い硫黄の結晶が付着していることもしばしば見受けられます。

しかし純粋な硫黄は無色な上に無臭です。
あの臭いは硫黄と水素が化合した“硫化水素”の臭いであることがほとんどです。
硫黄の化合物で有名なものは、先に上げた硫化水素の他に毒性の強い二酸化硫黄が挙げられます。
一定量以上の二酸化硫黄は呼吸器を刺激し、せき、ぜんそく、気管支炎など呼吸器系の障害を引き起こします。
1961年頃より発生した四日市ぜんそくの原因でもありました。

硫黄の応用
硫黄はゴムの品質を上げる役割も果たしています。
ゴムは炭素を混ぜることで強度を増し、硫黄を混ぜることせ弾力性を持ちます。
本来は一本の鎖のように繋がっているゴム分子に硫黄を混ぜることで、鎖状だった分子同士が繋がり、網目のような形を作ります。
この網目の構造によて伸び縮みする幅が増え、弾力性を持つようになります。

また、硫黄の最も重要な用途は硫酸の製造です。
硫酸は二酸化硫黄を酸化させて水と反応させることで作られています。
SO2→SO3→H2SO4
二酸化硫黄→三酸化硫黄→硫酸
流れを見ると単純ですが、実際の反応はちょっと複雑です。
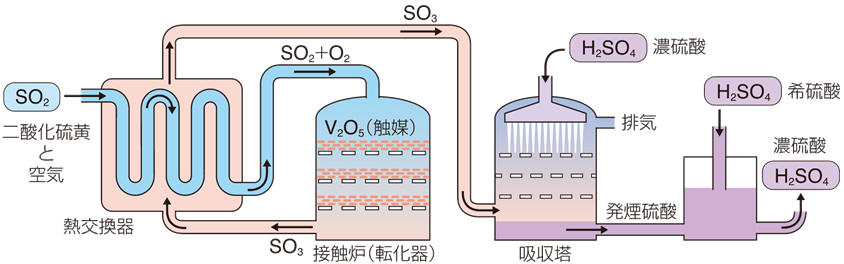
高校科学で学ぶ硫酸の製法(接触法)を例に上の図の流れを追うと…。
まずSO2(硫酸)をV2O5(五酸化バナジウム)を触媒にしてSO3(三酸化硫黄)が作られます。
その後、作られたSO3(三酸化硫黄)を用意された濃硫酸に溶かすことで発煙硫酸します。
最後に発煙硫酸に水(H2O)が混ざることでH2SO4(硫酸)が完成します。
というように硫酸を作ることができます。

硫酸は強い酸性を示す他、沸点が高く揮発しない特徴があります。
吸湿性もあり中性・酸性気体の乾燥剤としても使われています。
また脱水作用を示す実験では、砂糖に硫酸をかけて様子を見る実験が有名です。


コメント