精神疾患の治療において、抗うつ薬や抗不安薬などの精神科薬は広く使用されています。
しかし近年、こうした薬の効果や副作用が腸内細菌叢(マイクロバイオーム)によって左右される可能性が注目され始めています。
これは、腸内細菌は消化や免疫調節、代謝に深く関与するだけでなく、神経伝達や情動にも影響を与えることが要因と考えられています。
また、多くの薬剤は経口投与されるため、腸内で細菌と直接接触することになり、そこで化学的な変換を受ける可能性が指摘されています。
これにより薬効が減弱したり、あるいは副作用が変化したりすることが考えられます。
今回は、そんな腸内細菌と薬についての研究がテーマです。
以下に研究の内容をまとめます。
参考研究)
・Does Gut Microbiome Composition Influence the Efficacy of Psychiatric Drugs?(2025/05/13)
腸内細菌と薬剤の双方向的な関係
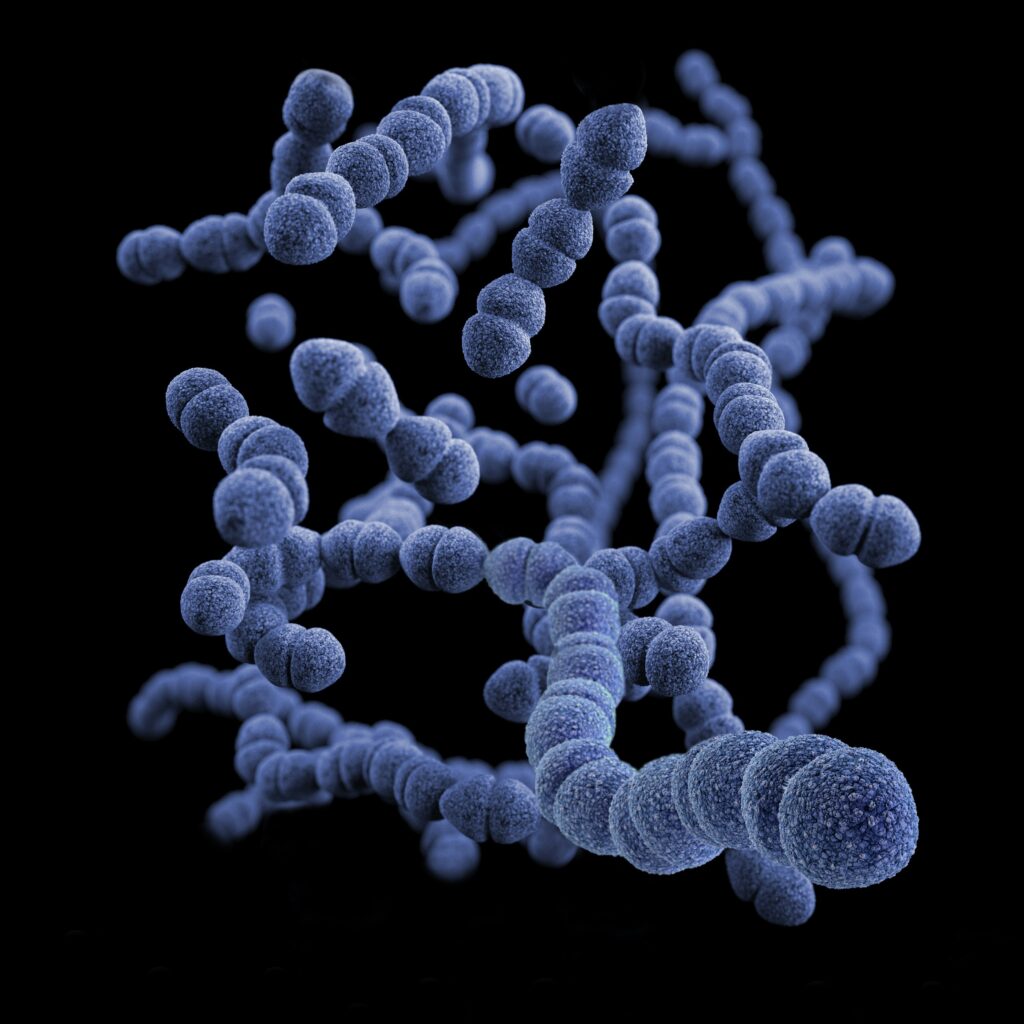
人間の腸には約38兆もの微生物が生息しており、その多くは細菌ですが、真菌や古細菌、ウイルスも含まれています。
腸内細菌は食物の分解、胆汁酸の代謝、ビタミン合成、免疫調整、さらには神経系への影響まで、多様な役割を担っています。
このバランスが崩れると、炎症性腸疾患(IBD)、がん、糖尿病、神経疾患など、さまざまな病気と関連することが知られています。
腸内細菌叢は動的であり、宿主の遺伝的要因だけでなく、食事や薬剤などの環境要因によっても大きく左右されます。
特に抗生物質は有害な細菌を死滅させたり増殖を抑える働きがある一方、腸内細菌叢に深刻な影響を及ぼし、一度の投与で炭水化物発酵や胆汁酸代謝といった基本機能を担う菌が一時的に消失することがあります。
一般的には数週間で回復しますが、人によっては6か月以上かかる場合もあり、その間に免疫力の低下や別の感染症のリスク増大が起こり得ます。
抗生物質以外の薬剤も腸内細菌に影響を与えることが分かってきています。
たとえば糖尿病治療薬のメトホルミンは腸内の菌構成を変化させ、その結果として糖代謝を促進し、薬効を高めることが報告されています。
また、リウマチ治療薬メトトレキサートも腸内細菌叢を変化させ、その変化した細菌叢を無治療のマウスに移植すると免疫活性が低下するという現象が確認されています。
さらに抗精神病薬リスペリドンは腸内細菌によって化学的に変換され、尿中に早期排泄されることが分かっており、このことが患者ごとに薬効の差が出る理由の一つと考えられます。
腸内細菌と不安・うつ病の関係
不安障害やうつ病は最も一般的な精神疾患であり、生活の質を大きく低下させます。
これらの疾患と腸内細菌の関連性については、マウスモデルと臨床研究の両面で研究が進められています。
無菌マウス(生まれつき腸内細菌を持たないマウス)は通常のマウスよりも不安行動が少なく、幼少期に通常の腸内細菌を導入すると標準マウスと同じ不安行動を示すようになります。
また、ストレスを受けたマウスの腸内細菌を移植された無処置マウスが、うつ病様の行動を示すことも確認されています。
逆に、Lactobacillus属の菌を補充すると症状が軽減することも報告されています。
さらに、腸内細菌が作り出す代謝産物が神経細胞に作用する例もあります。
例えば、腸内代謝物の一つである4-ethylphenyl sulfate(4-EPS)はマウスの不安行動を増強し、オリゴデンドロサイトの分化を妨げます。
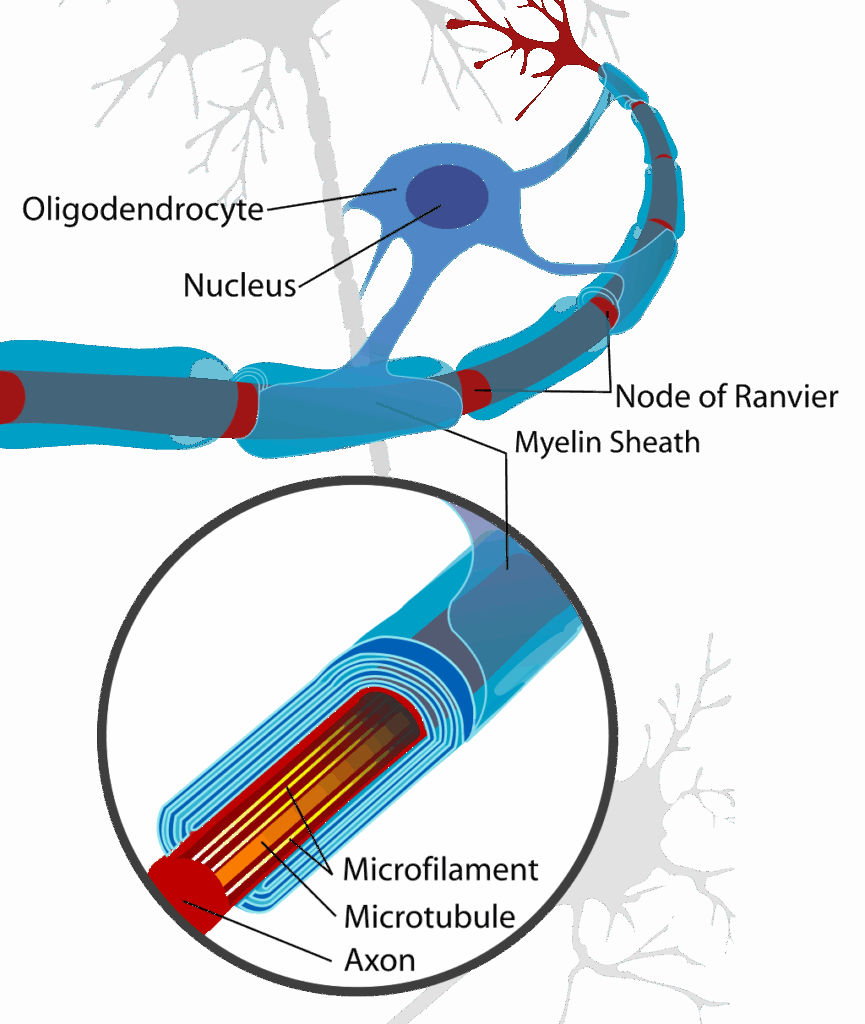
【オリゴデンドロサイト(希突起膠細胞)】
中枢神経系に存在するグリア細胞の一種
神経細胞の軸索をミエリンで覆うことで、神経信号の伝達を速める役割を担っている
一方で、Bacteroides fragilis を投与すると、不安行動や自閉症様の特徴が緩和されることが分かっています。
ヒトの研究では、うつ病患者の腸内細菌叢にはSubdoligranulumやCoprococcusの減少、Eggerthellaの増加といった特徴的な変化が確認されています。
こうした変化は脂質代謝の亢進など代謝プロファイルの変化と併せて観察されており、マイクロバイオームと精神疾患との関連を裏付けています。
精神科薬と腸内細菌の相互作用

抗うつ薬として広く用いられるSSRI(選択的セロトニン再取り込み阻害薬)やSNRI(セロトニン・ノルアドレナリン再取り込み阻害薬)は、効果の発現に時間がかかるだけでなく、患者によって効き方に大きな差があります。
その一因として腸内細菌叢の違いが薬物代謝や吸収に影響している可能性があります。
実験的には、多様な腸内細菌株に精神科薬を曝露すると、一部の菌株は薬を分解し、活性を低下させることが確認されています。
特にフルオキセチン(SSRI)は多くの腸内細菌によって代謝されやすいことが報告されています。
さらに、同じ薬であっても、ある腸内細菌叢では分解され、別の腸内細菌叢では分解されないという違いが見られることから、個人ごとの反応差の背景に腸内細菌の構成が関わることが示唆されます。
また、細菌が薬を化学的に変換するだけでなく、薬を取り込んで蓄積する(バイオアキュムレーション)現象も確認されています。
例えば、SNRIであるデュロキセチンは様々な腸内細菌に取り込まれ、代謝や分泌パターンに影響を与えることが分かっています。
このような現象は薬の有効性や行動への影響にも直結し得ます。
今後の展望と課題
こうした知見はまだ初期段階にあります。多くの実験は培養系やマウスモデルで行われており、ヒトにおける臨床的な意義についてはさらなる研究が必要です。
特に、薬剤の長期使用が腸内環境を二次的に変化させ、そのことが再び治療効果や副作用に影響を与えるという仮説は魅力的ですが、現時点では実証されていません。
今後はマルチオミクス解析(ゲノム、メタボローム、トランスクリプトームなどの統合解析)や大規模な患者コホート研究、さらに動物モデルを組み合わせることで、腸内細菌叢が薬効や副作用をどのように左右するのかを明らかにしていくことが求められます。
将来的には、腸内細菌の状態をバイオマーカーとして利用し、患者ごとに最適な薬剤選択や投与量を決定する「個別化医療」が現実味を帯びてくるかもしれません。
このアプローチは精神科薬にとどまらず、糖尿病薬やがん免疫療法など幅広い領域にも応用可能であると考えられています。
まとめ
・腸内細菌叢は精神疾患の発症や進行に影響を与える可能性があり、抗うつ薬や抗不安薬の効果にも関与していることが示唆されている
・一部の腸内細菌は薬剤を化学的に変換したり、取り込んで蓄積することで薬効を変化させることが確認されている
・今後の研究により、腸内細菌のプロファイルを基に個別化した精神科治療の可能性が期待されている

















コメント