腸内細菌と心身との関係が盛んに研究されている今日この頃。
この度、ルーヴァン・カトリック大学および、インペリアル・カレッジ・ロンドンらの大学の研究によって、腸内細菌が産生する特定の分子が、糖尿病の発症に深く関与する炎症経路を抑制し、血糖コントロールを改善する可能性が示されました。
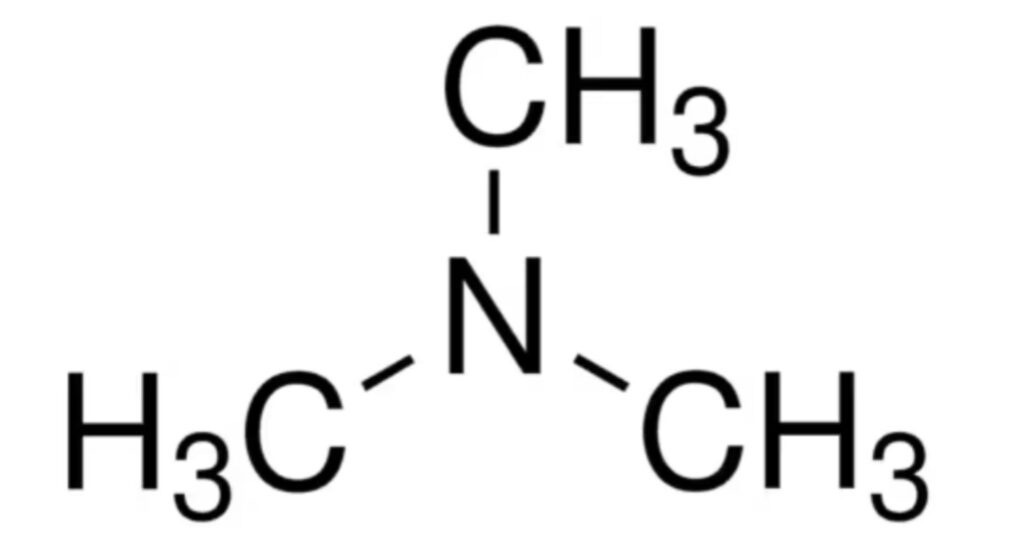
今回の研究で注目されたのは、腸内細菌が食事由来のコリンを材料として産生するTMA(トリメチルアミン)という分子です。
研究チームは、この分子が糖尿病の根本的な要因として知られる慢性炎症を抑え、代謝を改善する新たなルートを生み出すことを突き止めました。
以下に研究の内容をまとめます。
参考記事)
・Gut molecule shows remarkable anti-diabetes power(2025/12/08)
参考研究)
・Inhibition of IRAK4 by microbial trimethylamine blunts metabolic inflammation and ameliorates glycemic control(2025/12/08)
20年越しの研究に一つの結論
今回明らかになったメカニズムは、約20年前から続く研究が関係しています。
研究の起点となったのは、ルーヴァン大学の研究員Patrice Cani氏が行った研究です。
彼は、高脂肪食を摂ると腸内から細菌由来の分子が血中に入り込み、免疫系を刺激して炎症が生じることを見いだしました。
この炎症反応がインスリン抵抗性に直接つながるという大胆な仮説は、研究開始当時は懐疑的に受け止められていたものの、現在では広く受け入れられた科学的事実となっています。
その後、2025年に入った現在、高脂肪食が引き起こす炎症と代謝障害の負の連鎖をどのように断ち切るかという点に新たな光を当たりました。
その中心となったのが、腸内細菌が作り出すTMAであり、この分子が血糖コントロールを改善する働きを持つことが明確に示されたのです。
TMAは免疫反応の中核タンパク質IRAK4を遮断する
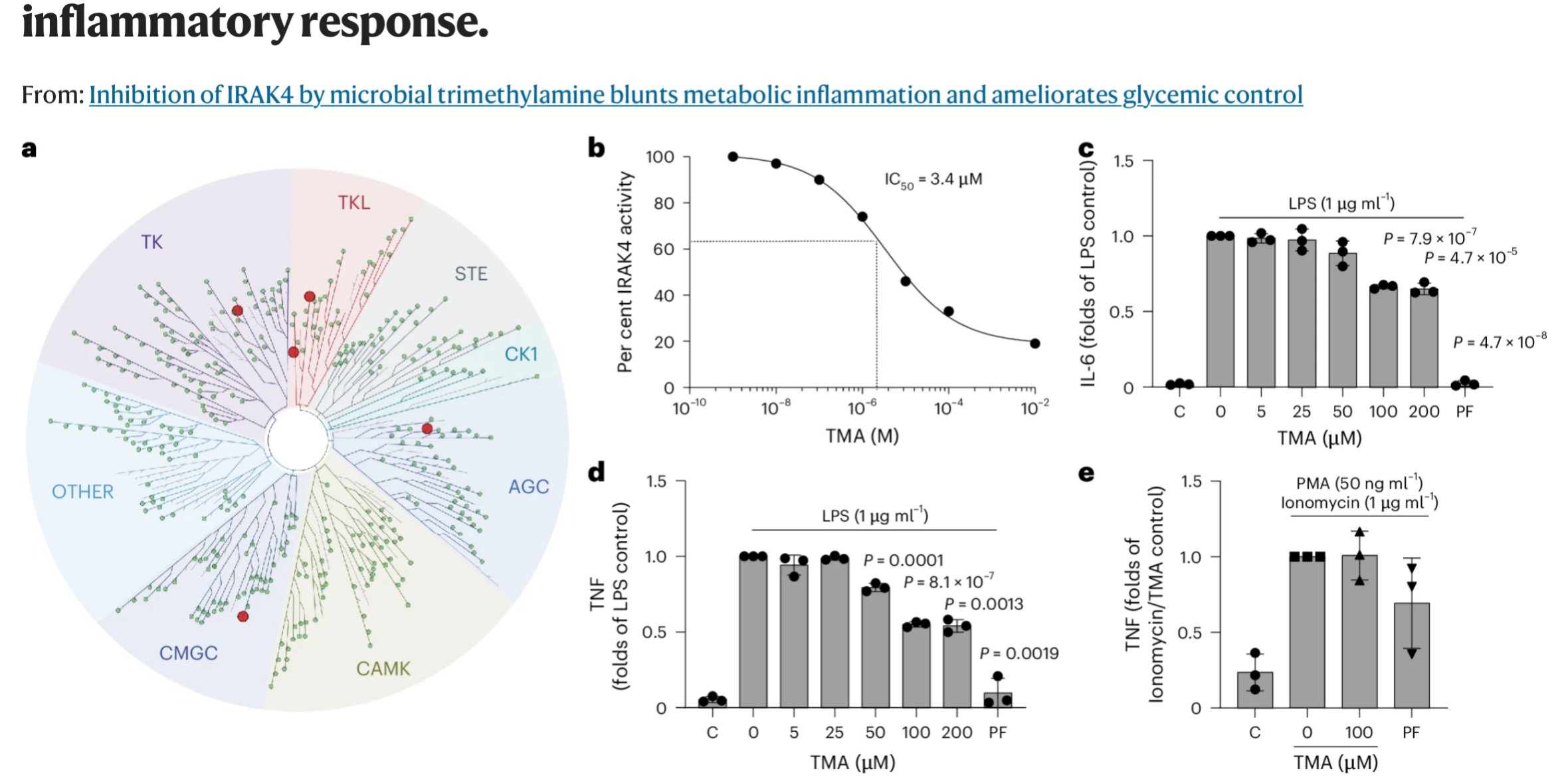
研究チームは、TMAがどのようにして糖代謝を改善するのかという点を詳細に解析しました。
鍵を握るのは、IRAK4(Interleukin-1 receptor-associated kinase 4)と呼ばれる免疫調整タンパク質です。
IRAK4は、体が高脂肪食などの「代謝ストレス」を受けた際に、免疫細胞へ炎症反応を開始させる信号を送る重要なタンパク質です。
短期的な炎症は体を守るために必要ですが、長期にわたる高脂肪食の摂取などによりIRAK4が過剰に刺激され続けると、炎症が慢性化します。
慢性炎症は、インスリンが正常に働くことを妨げる主要因であり、糖尿病発症の中心的なメカニズムとして広く認識されています。
TMAがIRAK4の働きを弱める
研究では、以下の3つの方法を組み合わせてTMAの作用を検証しました。
• ヒト細胞を用いた培養実験
• 動物(マウス)を用いた代謝試験
• 分子レベルでのスクリーニング解析
これらの結果、TMAはIRAK4に直接結合してその活性を弱めることが確認されました。
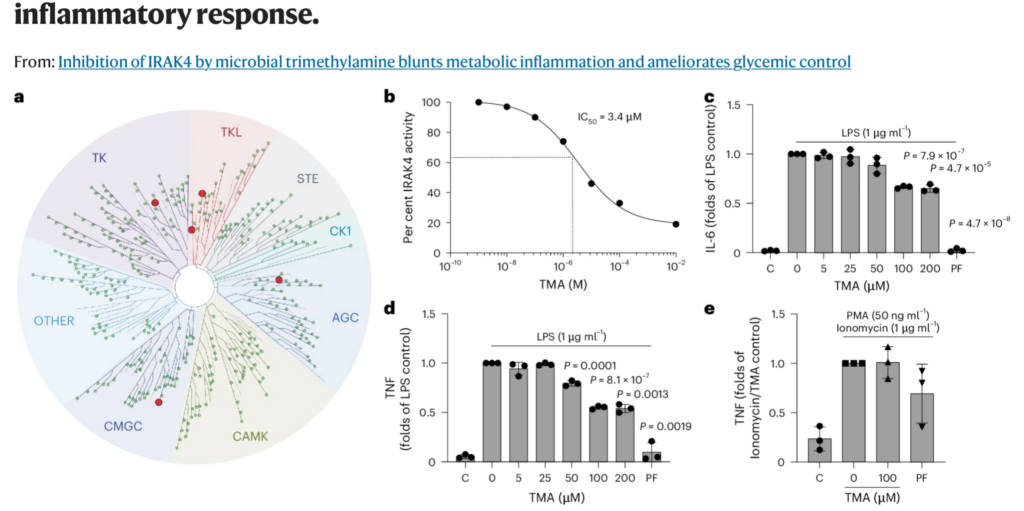
この作用により、脂肪の摂りすぎによって誘発される炎症反応が抑制され、体内のインスリン応答が回復するという重要な効果が認められたのです。
さらにTMAは、敗血症(sepsis)モデルのマウスにも高い保護効果を示し、過剰炎症による死亡率を大きく下げました。
これは、TMAが炎症の暴走を抑える力を持つことを裏付ける重要な結果です。
IRAK4を標的とした治療戦略が広がる可能性
TMAがIRAK4に作用するという発見は、糖尿病治療の新たな方向性を示すものです。
研究チームは、TMAの効果が本当にIRAK4依存で起きているのかを確かめるため、次の追加実験を行いました。
• IRAK4遺伝子を除去したマウス
• IRAK4阻害薬を投与したマウス
その結果、どちらもTMAと同じ代謝改善効果を示したことが確認されました。
IRAK4はすでに創薬の標的としてよく研究されている分子であるため、この発見は糖尿病治療薬の開発を大きく前進させる可能性を持ちます。
世界5億人の糖尿病患者に新たな希望となる可能性
現在、世界では5億人以上が糖尿病を抱えていると言われています。
この状況において、TMAのような「腸内細菌が生むシグナル分子」が免疫や代謝を直接調節するという発見は、これまでの治療法とは異なる革新的なアプローチをもたらします。
研究者によれば、以下のような方向性が今後期待されています。
• TMA産生を促す食品・食習慣の特定
• TMA生成を助けるプロバイオティクスの開発
• TMAの作用を模倣した医薬品の開発
ただし、TMAに関する研究はまだ発展段階にあり、食品からの摂取量の違い、個々人の腸内細菌叢の差、長期的な摂取による影響などは十分に明らかになっていません。
そのため、効果の大きさや安全性に関しては今後の追加研究が必要です。
まとめ
・TMAはIRAK4の活性を抑制し、慢性炎症とインスリン抵抗性を改善する可能性が示された
・TMA産生は腸内細菌と食事の相互作用によって生まれ、代謝改善に寄与する新たなメカニズムとして注目されている
・IRAK4を標的とする治療戦略はすでに確立されているため、糖尿病治療薬の開発が加速する可能性がある















コメント