近年、二型糖尿病や肥満治療薬として世界的に注目されているオゼンピック(Ozempic)。
主成分であるセマグルチドが血糖値の調整や食欲抑制に効果を発揮することが知られており、ウゴービやリベルサスといった同じ成分を配合した薬も利用されています。
しかし、それらは人工的に作られた薬であり、長期使用による副作用やコストの問題も指摘されています。
そうした中、中国のジャンナン大学を中心とする研究チームは、腸内細菌とその代謝産物が、オゼンピックの作用と類似した血糖コントロールや甘味嗜好の抑制を自然に促す可能性を持つことを突き止めました。
この成果は、将来的に薬を使わずに糖尿病予防や食生活改善を行うための新しい戦略になる可能性があります。
今回のテーマとして、以下に研究の内容をまとめます。
参考記事)
・Scientists May Have Identified a Natural Alternative to Ozempic(2025/08/12)
参考研究)
・Free fatty acid receptor 4 modulates dietary sugar preference via the gut microbiota(2025/01/13)
GLP-1とは何か ― 自然な血糖コントロールの鍵
オゼンピックの有効成分であるセマグルチドは、グルカゴン様ペプチド-1(Glucagon-like peptide-1:GLP-1)というホルモンの作用を模倣する薬です。
GLP-1は体内で自然に産生され、食後の血糖値を下げるほか、満腹感を促す働きがあります。
本来、特定の食品や腸内細菌の働きによって分泌が刺激されますが、二型糖尿病患者ではGLP-1の機能が低下していることが多く、血糖コントロールが困難になるのです。
そのため、現在の医療ではGLP-1受容体作動薬が治療に用いられていますが、薬に頼らずに体内で自然にGLP-1を増やす方法は、これまで明確にされていませんでした。
研究の背景 ― 甘い食べ物と腸内環境の関係
論文の著者らは、「私たちの食欲や嗜好は、腸から発せられる信号によって強く影響を受ける」と説明しています。
しかし、これまでの研究では、甘みの渇望の調整に関与する具体的な遺伝子、腸内細菌、代謝産物が何であるかは明らかではありませんでした。
そこで研究チームは、腸内細菌の種類とその代謝産物に注目し、それらが血糖コントロールや甘味嗜好にどう影響するのかを、マウスとヒトを対象に解析しました。
Phocaeicola vulgatusとの関係
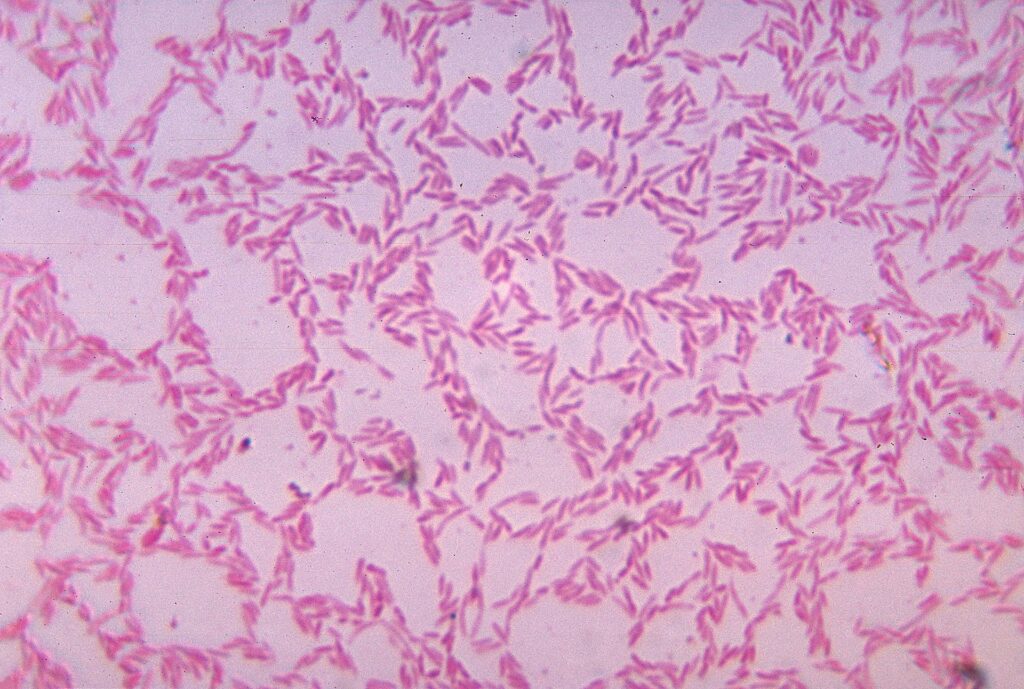
実験の結果、Phocaeicola vulgatus(旧:Bacteroides vulgatus)という腸内細菌が重要な役割を果たしていることがわかりました。
Phocaeicola vulgatusの顕微鏡画像 【一般的知見】
・ヒト糞便中で高頻度に検出され、食物繊維や多糖類を分解して短鎖脂肪酸を産生
・腸管バリア機能の維持や免疫系の調節にも寄与すると考えられている
【臨床・疫学的意義】
・腸内バランスが崩れると過剰増殖あるいは機能低下により炎症性腸疾患や代謝性疾患との関連が示唆される
・冠動脈疾患と診断された患者では、P. vulgatusおよびP. doreiの腸内存在量が有意に低下しているとの報告あり
研究チームは、糖尿病を発症させたマウスにおいて、この細菌の存在量を増やすことでGLP-1の分泌が活性化されることを確認しました。
さらに、このGLP-1の分泌は、もう一つの重要なホルモンであるFGF21(Fibroblast Growth Factor 21)の分泌を誘発します。
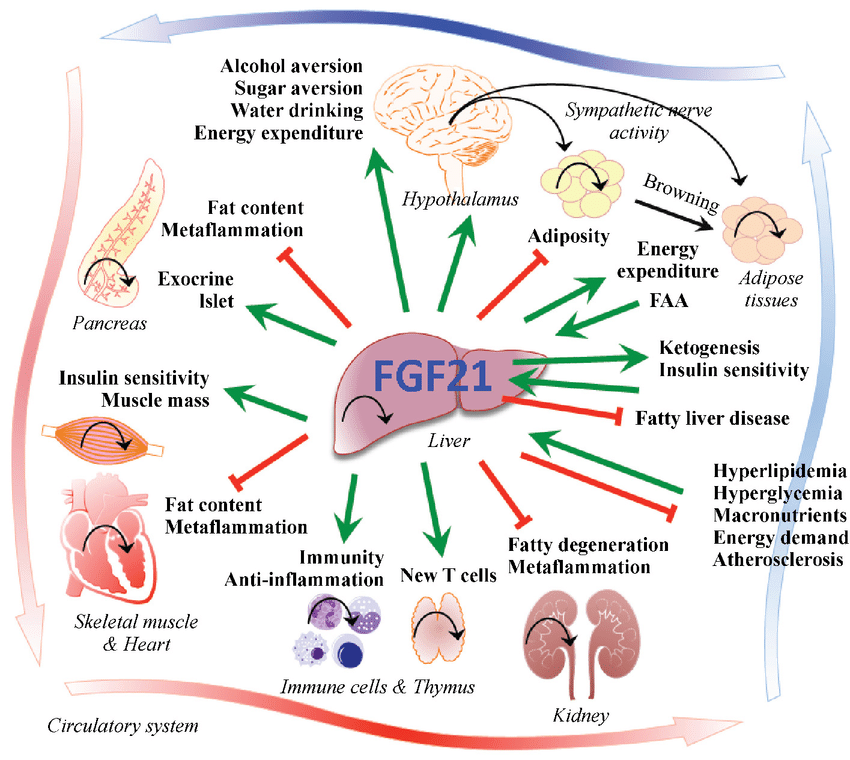
FGF21は甘味嗜好の抑制と血糖値の安定化に関与しており、この二重作用が糖尿病予防に有効である可能性が示されました。
分子メカニズム ― Ffar4遺伝子の役割
研究チームはさらに、Ffar4と呼ばれる腸内タンパク質に着目しました。
マウス実験では、このFfar4を作り出せない場合、腸内のB. vulgatusの数が減少し、結果としてFGF21の分泌が減少しました。
この状態では甘味嗜好が強まり、糖尿病リスクが高まる可能性があると報告されています。
また、ヒトの遺伝子解析でも、Ffar4の変異を持つ人はFGF21の産生量が減り、砂糖への嗜好が高まる傾向が見られました。(FGF21 — the cause of having a ‘sweet tooth’?より)
この関連性は、60人の二型糖尿病患者と24人の健常者を対象にした血液分析から確認されています。(Free fatty acid receptor 4 modulates dietary sugar preference via the gut microbiotaより)
GLP-1作動薬との関係 ― 同じFGF21経路を刺激
既存のGLP-1作動薬による治療では、FGF21の分泌が刺激されることが知られています。
今回の研究は、薬を使わずに腸内細菌とその代謝産物を利用して、同様の経路を活性化できる可能性を示しました。
具体的には、B. vulgatusが作り出す代謝産物をマウスに投与すると、GLP-1の分泌が増加し、その結果FGF21の分泌も促されるという仕組みが確認されました。
これにより、血糖値の安定化と甘味嗜好の低下が同時に実現されたのです。
ヒトへの応用可能性と課題
この発見は大きな可能性を秘めていますが、現時点ではマウス実験の結果が中心であり、ヒトでも同じ効果が得られるかは未確認です。
また、腸内細菌の増加をどのように安全かつ持続的に行うか、代謝産物をどのように投与・利用するかといった実用化への課題も残されています。
著者らは、この研究が「糖尿病予防の戦略を提供する」と述べていますが、その効果や安全性を立証するためには、長期的かつ大規模な臨床試験が必要です。
本研究は、腸内細菌を活用した新しい糖尿病予防・治療法の可能性を示すものです。
現在の薬物療法は確かに効果的ですが、薬の長期服用による副作用、経済的負担、依存性などが問題視されています。
もし腸内環境の調整だけで同様の効果が得られるなら、患者の生活の質(QOL)は大きく向上するでしょう。
特に、食欲や嗜好の制御を腸内からアプローチするという視点は、肥満や生活習慣病の包括的な対策に有効と考えられます。
今後の展望
今後は、B. vulgatusの増加を促す食事やプロバイオティクスの開発、代謝産物の安全な利用方法の確立が重要なテーマになります。
また、遺伝子変異によってFfar4やFGF21の機能が低下している人に対しては、パーソナライズド栄養療法が有効になる可能性もあります。
このような個別化医療と腸内細菌研究の融合は、糖尿病予防の新しい道を切り開くことが期待されています。
まとめ
・Phocaeicola vulgatusとその代謝産物がGLP-1とFGF21の分泌を促進し、血糖コントロールと甘味嗜好抑制に寄与する可能性がある
・Ffar4遺伝子やFGF21の機能低下は甘味嗜好の増加と糖尿病リスク上昇に関係
・現時点ではマウス実験が中心であり、ヒトでの効果や安全性は未検証


















コメント