単体の中には同じ元素なのに性質が異なるものがあります。
酸素原子が2つ結びついた酸素O₂は、無色・無臭の気体で、空気中の約20%を占める馴染み深い気体です。
同じ酸素原子3つ結びつくと、反応性が高く有毒なオゾンO₃となります。

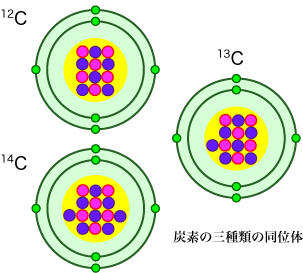
炭素の同素体
有名な同素体としては、炭素系の同素体が挙げられます。

同素体の性質の違いを知るときは、ダイヤモンドやグラファイトの特徴を見ると分かりやすいです。
【ダイヤモンド】

ダイヤモンドは炭素が立体的に結合した姿です。

炭素が持つ4つの価電子を全て共有結合(強い結びつき)させているので、とても硬い性質があります。
共有結合でできた結晶は以下のような特徴がよく見られます。
・電気を通さない
・水に溶けにくい
・融点が高い
・硬い
【グラファイト(黒鉛)】

グラファイト(黒鉛)は3つの価電子が共有結合した炭素同素体です。
ダイヤモンドは4つの価電子を使って立体の形をとることができましたが、グラファイトは3つしか結合しないので、頑張っても平面の構造しかとることができません。

先程3つの価電子は結合していると言いましたが、残りの1つはというと…、飛び回って遊んでいます。(自由電子)
そのため3つの価電子で作れる効率的な平面形にしかくっつくことができないのです。
「じゃあ何で鉛筆はくっついたりして塊になっているの?」
という疑問が湧いてきます。
答えとしては、
「分子と分子の間には引きつけ合う力(分子間力)がある。」
からです。
「…?」な場合は、原子の力ではなく引力でくっついていると思っておけばOKです。
しかしこの分子間力は力が弱いため、外部からの力ですぐに離れてまいます。
グラファイトは横の繋がりは強いですが、縦の繋がりは弱いことが分かります。
よって鉛筆の芯にちょっとの力をかけだけで黒鉛が崩れ、字が書けるのです。
同じ炭素でも結合が少し変わっただけで性質が大きく変化するのがまた面白いところです。
また、炭素の同素体にフラーレン(C60)やカーボンナノチューブが存在します。
ちょっと面白いストーリーもあるので、いずれ別の機会に紹介しようと思います。


















コメント