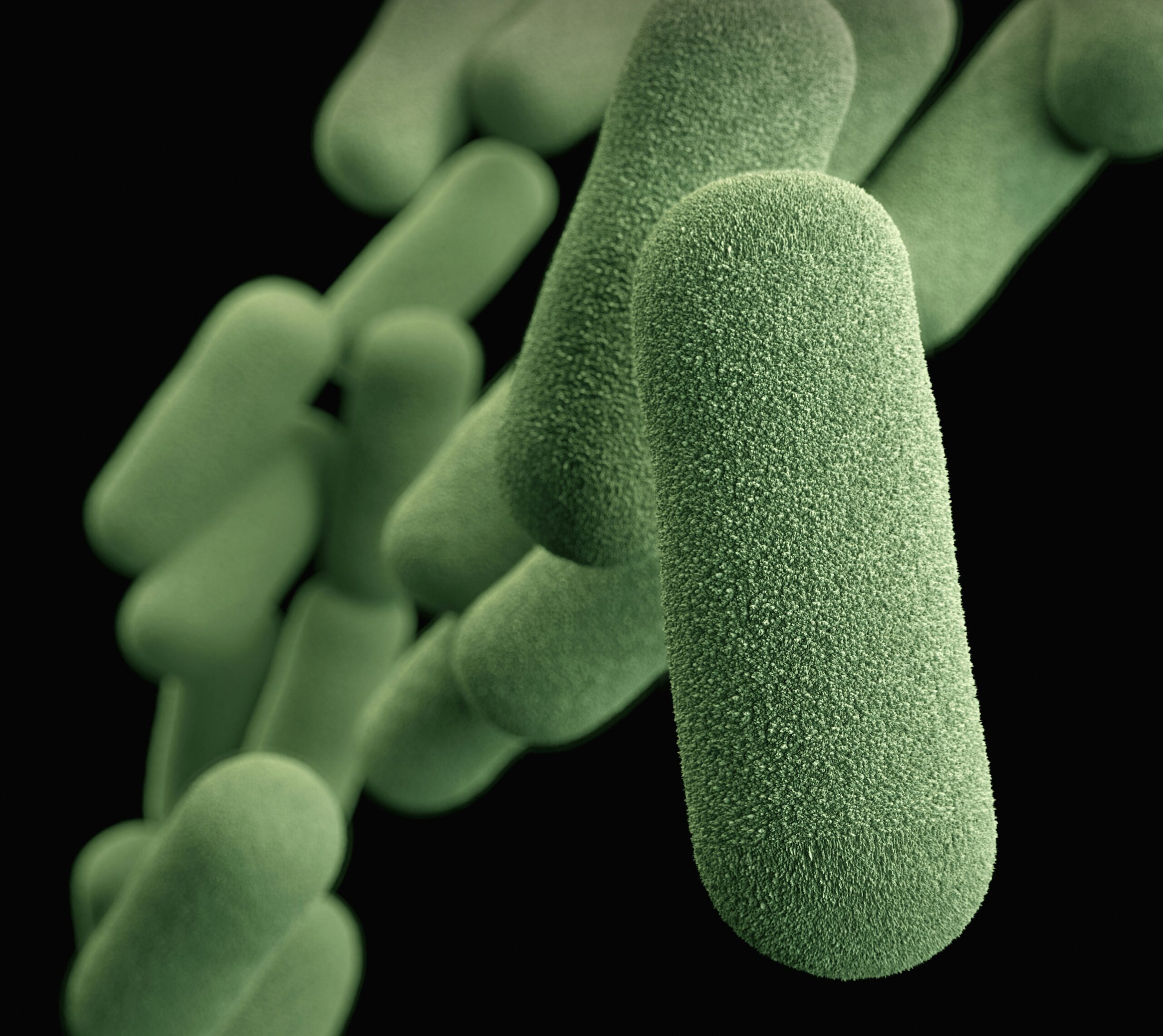
腸内細菌は私たちの体の中で単なる共存者ではなく、周囲の化学環境を鋭敏に感知し、栄養を探し、他の細菌と“対話しながら”生態系を維持しています。
この感覚能力がどのように働き、健康にどのような影響を与えるのかは、近年の腸内微生物研究における重要なテーマです。
2025年に発表された論文『Specificities of chemosensory receptors in the human gut microbiota』では、腸内に常在する有益な細菌がどのような化学信号を感知しているのかを体系的に解析した初めての研究として報告されています。
今回のテーマとして以下に研究の内容をまとめます。
参考記事)
・Specificities of chemosensory receptors in the human gut microbiota(2025/07/26)
モデル生物中心の研究から“共生細菌”への視点転換
従来の微生物研究では、細菌の化学的な感知機構は主に 病原性細菌(ヒトに害を及ぼす細菌) を用いたモデル研究が中心でした。
しかしヒト腸内には 病原性ではなく、健康維持に寄与する“共生細菌” が多く存在します。
このような細菌がどの化学情報を感知しているのかは、これまでほとんど明らかにされていませんでした。
研究チームはこの知識の空白を埋めるべく、“環境化学シグナルに対する腸内有益細菌の受容体特異性”を解析しました。
腸内細菌は環境中の多様な代謝物を識別できる
研究の対象は、Clostridia(クロストリジア) と呼ばれる運動性(自ら移動可能な)細菌群で、ヒト腸内に多く存在し健康維持に重要な役割を果たすことが知られている細菌群です。
研究チームは、腸内細菌由来の受容体(化学物質を認識するタンパク質)が、どのような分子を認識するのかを徹底的に調べました。
その結果、腸内細菌の受容体は予想以上に広範な代謝産物を識別できることが明らかになりました。
具体的には、以下のよう物質が感知対象に含まれていました。
• 炭水化物分解物
• 脂質分解物
• タンパク質分解物
• DNA分解物
• アミン類
など
これらの化合物は、食べ物の消化や他の細菌の代謝活性によって腸内で生成されます。
さらに、体系的なスクリーニングにより、異なるセンサーが特定の化学物質群に対して選択的な“好み(特異性)”を持つことも判明しました。
これにより、腸内細菌は環境中の“意味のある化学情報”を読み取り、移動や行動を制御している可能性が示されたのです。
乳酸とギ酸が特に重要なシグナルとして浮上

運動性腸内細菌が移動する主な動機は、栄養を探すことだと考えられています。
研究では、実験的解析とコンピュータによるバイオインフォマティクス解析(DNA、RNA、タンパク質などの膨大な生物データの解析)を組み合わせ、細菌の運動を制御する受容体に結合する多数の化学リガンド(結合分子) を同定しました。
結果として、次の点が明らかになりました。
・多くの化学物質の中で、乳酸(lactate)とギ酸(formate) が最も頻繁に受容体刺激として検出された
・このことは、乳酸とギ酸が腸内細菌にとって特に重要な栄養源である可能性が高いことを示唆する
乳酸やギ酸は、腸内での発酵や他の細菌の代謝によって生成されることがあり、腸内環境における細菌間の“栄養のやり取り(クロスフィーディング)”を促進する重要な役割を担っている可能性があります。
ただし、この研究は主として受容体の結合特性に着目しており、腸内での実際の濃度や人体への直接的な影響については、今後の精密な臨床研究が必要です。
“クロスフィーディング”による細菌間の協力関係
研究チームは、一部の腸内細菌自身が乳酸やギ酸を産生できることを確認しました。
これが意味するのは、ある種の細菌が生み出す代謝物を、別の種類の細菌が栄養源として利用する“クロスフィーディング” が腸内で広く起きている可能性があるということです。
これは、細菌同士の協力的相互作用を通じて腸内環境を安定化させる重要な仕組みです。
研究の第一著者である Wenhao Xu氏は次のように述べています。
「これらのドメインは腸内における細菌同士の相互作用にとって重要であり、健康なヒトマイクロバイオームにおいてキーの役割を果たしている可能性がある」
新しい感覚受容体とその構造解明
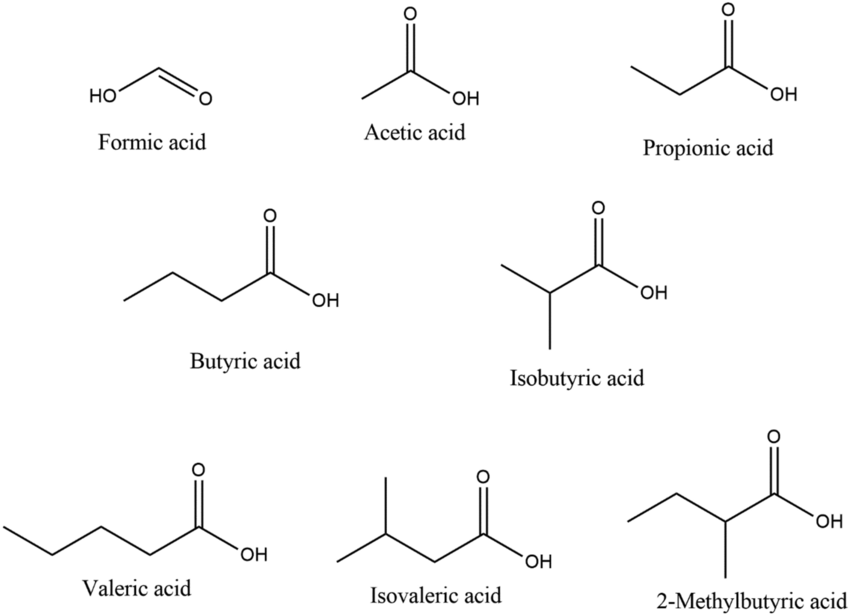
チームはさらに、これまで知られていなかったいくつかのセンサードメイン(化学感知部位)を同定しました。
これらは以下のような物質に特異的に反応します。
• 乳酸
• ジカルボン酸
• ウラシル(RNA の構成要素)
• 短鎖脂肪酸(SCFAs)
また、ウラシルと酢酸(acetate)の両方に反応する“二重センサー”の結晶構造が決定され、その結合機構が分子レベルで解明されました。
これにより、細菌がどのように化学物質を“読むか”が具体的に理解できるようになりました。
これら解析の結果、類似した受容体ドメインでもリガンド(結合分子)特異性が進化の過程で比較的容易に変わることが明らかになりました。
これは、細菌が環境の変化に応じて感知能力を進化的に調整してきた可能性を示しており、腸内環境の変動に適応する細菌の柔軟性を理解するうえで重要な知見です。
研究の意義と今後の展望
本研究は、腸内細菌が高度な化学感知能力を持ち、環境情報を選択的に読み取りながら行動していることを体系的に示した初の研究です。
病原菌中心だった従来の研究とは異なり、腸内に常在する善玉細菌のセンサーネットワークの特性と機能を解明した点に大きな意義があります。
しかしながら、以下のような点はなお不明確であり、今後の研究課題とされています。
• 実際のヒト腸内での化学物質濃度との関連
• 食事内容や疾患状態との具体的な結びつき
• 健康への影響を直接証明する臨床的証拠
したがって、今回の研究は基礎的な科学的理解を進めるものであり、直接的な健康効果の断定には至っていません。
まとめ
・腸内に常在する有益細菌は、環境中の多種多様な代謝物を選択的に感知していることが明らかになった
・乳酸やギ酸などの特定化学物質が重要な栄養シグナルとして浮上し、細菌間の“クロスフィーディング”が腸内生態系を支えている可能性がある
・新規感覚受容体の発見と進化的柔軟性の解析によって、腸内細菌の環境適応能力に関する理解が大きく進展した
















コメント