甘いものを食べると気分が落ち着く、と感じる人は少なくありませんが、ストレス状態での砂糖(ショ糖)摂取がうつ病態にどのように影響を与えるのかについては、十分に理解されていませんでした。
2025年12月に発表された藤田医科大学らによる研究から、ストレス環境下での砂糖摂取は、ノルアドレナリン系と糖代謝に影響を及ぼし、特定のうつ病サブタイプの病態形成に関与する可能性が示されました。
この研究は、食習慣とストレス環境を組み合わせた解析を行い、砂糖摂取がストレス下での行動・神経・代謝にどのような影響を及ぼすかを、疫学データと動物実験を用いて詳しく検証したものです。
以下に研究の内容をまとめます。
参考研究)
・Targeting the noradrenergic-metabolic axis: A new strategy for sugar-induced depression subtypes(2025/12/21)
研究の背景:うつ病と生活習慣
うつ病(Major Depressive Disorder, MDD)は、原因や症状、治療反応が個人によって大きく異なる疾患群です。
近年、生活習慣、特に食事とメンタルヘルスの関連性に注目が集まっています。
食習慣は身体の代謝状態や神経伝達系に影響を与えることが示唆されていますが、ストレス環境下での砂糖摂取がうつ病の行動・認知機能にどのように作用するかは不明な点が多いままでした。
この問題を解決するため、健康診断受診者の食事データに基づく解析 と、慢性ストレス下におけるショ糖摂取マウスモデル実験 を組み合わせることで、ストレスとの相互作用を検討しました。
データ解析:健康診断データからの示唆
まず、松波総合病院と共同で得られた健康診断受診者2840名の食事データを詳細に解析しました。
質問票による食習慣の情報を用い、甘味(ショ糖)摂取と抑うつ傾向(CES-D尺度)との関連を検討したところ、うつ傾向が強い人ほどショ糖摂取量が多い傾向が認められました。
性別に関係なくこの傾向は見られたものの、単なる統計的関連であり因果関係を証明するものではありません。
マウスモデル:慢性ストレス×ショ糖摂取
次に、慢性予測不能軽度ストレス(Chronic Unpredictable Mild Stress, CUMS)モデルを用いたマウス実験を行いました。
これはうつ病様行動を誘導する標準的なストレスモデルです。
これにショ糖溶液を自由摂取させる条件を加え、行動変化を測定しました。
ストレス環境下でショ糖を摂取したマウス(オス)は、次のような特徴的な変化を示しました。
• 過活動や攻撃性が軽減された(ストレス単独より攻撃性が低かった)
• 社会的相互作用の低下や絶望様行動は改善されなかった
• 記憶機能(認知)に障害が見られた
これらの結果は、ショ糖摂取がストレス下で必ずしも「気分改善」につながるわけではなく、特定の行動や認知機能には悪影響を及ぼす可能性を示しています。
また、攻撃性の抑制やうつ様行動、認知機能の障害のが見られたのはオスのマウスであり、メスでは逆にうつ様行動が改善される傾向があることも認められました。
ノルアドレナリン神経系と受容体の関与
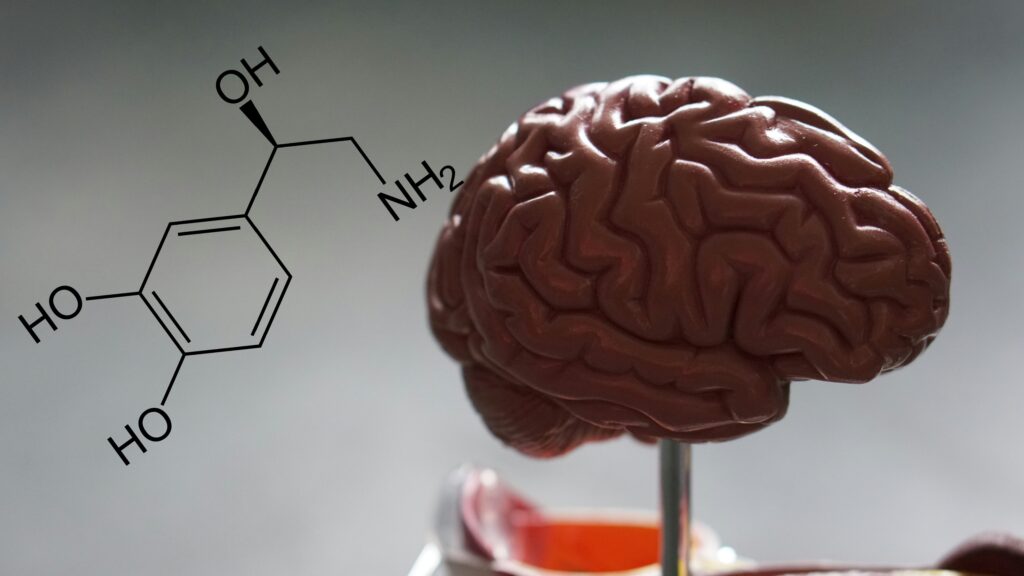
行動変化の背景として、前頭前皮質(PFC)における神経化学的変化も解析されました。
具体的には、ノルアドレナリン(NE)系の機能障害が深く関わっている可能性が示されたのです。
マウスでは、ストレスとショ糖条件下で以下のような変化が見られました:
• ノルアドレナリン放出が抑制される
• ノルアドレナリンα2受容体の発現が上昇
• α1受容体およびβ1受容体の発現レベルが低下
【用語】
・ノルアドレナリン
覚醒、注意、ストレス応答、記憶形成などを調節する神経伝達物質
・α1受容体
刺激されると:血管収縮や交感神経的興奮が強まり、血圧や緊張感が上がる
抑制されると:血管が拡張して血圧が下がり、末梢の交感反応が弱まる
・α2受容体
刺激されると:ノルアドレナリン放出が抑えられ、神経活動や覚醒が鎮まる
抑制されると:ノルアドレナリン放出が増え、覚醒や不安・興奮が高まりやすくなる
β1受容体
・刺激されると:心拍数と心収縮力が増して心拍出量が上がる
・抑制されると:心拍数と収縮力が低下し、心臓の負担や酸素需要が減る
この受容体の変化は、ノルアドレナリンの放出とシグナル伝達をさらに低下させる影響 を持つと考えられています。
これにより、ストレス下の行動異常や認知障害につながる可能性が高いとされています。
糖代謝の異常と行動との関連
ショ糖摂取下では 血糖値の上昇(高血糖)と関連する代謝異常が見られ、脳内の糖輸送や乳酸代謝関連遺伝子の発現変化も確認されました。
これは脳内のエネルギー代謝障害を意味し、行動や神経伝達にさらに影響する可能性があります。
このことは、単なる神経化学的変化だけでなく、身体と脳のエネルギー代謝との相互作用が病態形成に関与することを示唆しています。
こうした神経系の変化が行動にどう影響するかを検証するため、ノルアドレナリン受容体を標的とした薬剤介入も試みられました。
研究では以下の結果が得られました。
・α2受容体拮抗薬(例:アチパメゾール) によって、ショ糖摂取下で見られた行動異常(社会的欠損、無気力状態など)が部分的に改善された
・α2受容体作動薬(例:グアンファシン) は、これらの行異常化が誘発された
・抗うつ薬でノルアドレナリン放出を促す薬剤(例:ミルタザピン)が改善効果を示した
これらは、ノルアドレナリン系を標的とした治療戦略が個別化医療につながる可能性 を示唆します。
臨床的意義と限界

本研究は、ストレス下の食事習慣(砂糖摂取)と神経・代謝系の両面からうつ病病態を解明しようとした先駆的な試みです。
特にノルアドレナリン系の受容体変化と代謝異常の関連は、これまで十分に注目されてこなかった領域です。
しかし、本研究は ラットやマウスモデルおよび健康診断データ解析に基づいており、実際の臨床的うつ病患者全般への適用についてはさらなる検証が必要です。
具体的には、ヒトにおける原因と結果の因果関係、薬剤介入の有効性・安全性、性別差の生物学的基盤 などは今後の重要な課題です。
まとめ
・ストレス下のショ糖(砂糖)摂取は、ノルアドレナリン神経系の機能変化と糖代謝異常を介して行動・認知に影響しうることが示された
・ノルアドレナリン受容体(特にα2)を標的とした薬理介入が、ストレス×糖摂取の行動異常を改善する可能性があることが示唆された
・本研究は臨床への応用可能性を与えるが、ヒトへの一般化や治療応用にはさらなる検証が必要














コメント