世界では3秒に1人が認知症を発症しており、そのうち60〜70%を占めるのがアルツハイマー病です。
この疾患に関しては、長年にわたり科学者たちが精力的に研究を重ねてきましたが、現在のところ根本的な治療法はまだ存在しません。
この難治性疾患には、いくつもの原因が複雑に絡み合っており、それらすべてをまだ十分に理解できていないことが、治療の難しさにつながっています。
従来の研究では、アルツハイマー病の中核的な要因として、アミロイドβおよびタウタンパク質という2種類のタンパク質に注目が集まってきました。
アミロイドβは脳細胞の外側に粘着性のプラーク(しこり)を形成し、神経細胞間の通信を妨げるとされています。
タウタンパク質は、異常なリン酸化などでタンパク質が変化すると、本来結合する微小管から解離して凝集体を形成し、最終的に神経細胞の死を引き起こします。
このようなアミロイド斑と神経原線維変化は、アルツハイマー病の特徴的な所見として知られています。
この考え方は「アミロイド仮説」と呼ばれ、数十年にわたりアルツハイマー研究の中心的な理論として支持されてきました。
そしてこの仮説に基づき、アミロイドβを脳から除去することを目的としたモノクローナル抗体治療薬が開発され、近年ではいくつかが承認されるに至りました。
しかしながら、これらの治療薬は病気の初期段階でしか効果が見込めず、すでに進行したダメージを回復させることはできません。
さらに、副作用として脳の腫れや出血などを引き起こすリスクもあり、アミロイドβのみを標的とするため、タウタンパク質に対しては無効であるという課題も残されています。
そうした中、スウェーデンのカロリンスカ研究所から驚くべき発見が報告されました。
胃潰瘍の原因菌として広く知られるHelicobacter pylori(ヘリコバクター・ピロリ:以下H.ピロリ)のタンパク質が、アミロイドβおよびタウの蓄積を同時に阻害する可能性があるというのです。
以下に研究の内容をまとめます。
参考記事)
・Stomach Ulcer Bacteria Could Be a Surprise Ally Against Alzheimer’s(2025/06/18)
参考研究)
・Helicobacter pylori CagA protein is a potent and broad-spectrum amyloid inhibitor(2025/06/11)
細菌のタンパク質が神経変性を抑制する?
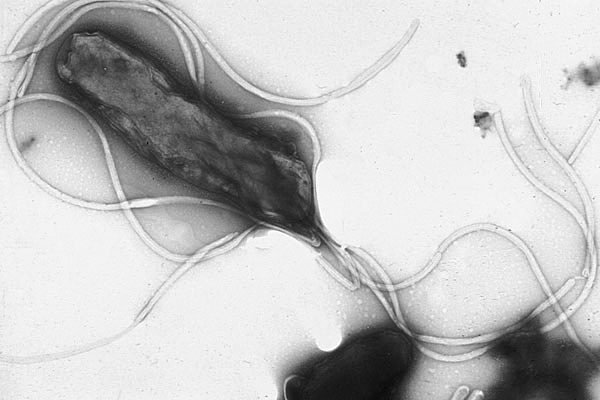
研究の発端は、当初アルツハイマー病とは無関係に見える、ある問いから始まりました。
研究者たちはまず、H. pyloriが他の微生物とどのように相互作用するかを調べていました。
多くの細菌は、バイオフィルムと呼ばれる保護構造を形成します。
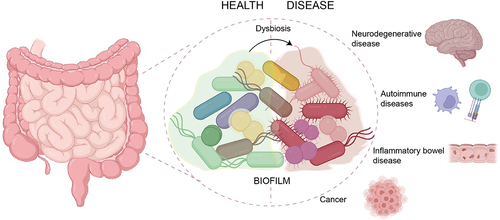
この構造には、アミロイド様構造(脳内で形成されるプラークに似た構造)であることが知られています。
このことから研究チームは、「H.ピロリが細菌同士のバイオフィルムに影響を与えるなら、人間のアミロイド構造にも影響するのではないか?」という仮説を立てました。
仮説の中で注目されたのが、H.ピロリのCagA(キャグエー)タンパク質でした。
このタンパク質のC末端部分(C-terminal region)は胃がんの発生など病原性が高いことで知られていますが、N末端部分(N-terminal region)は、逆に細胞に対して保護的な性質を持つ可能性があるとされていました。
研究チームはこのN末端断片をCagANと命名し、さっそく実験を開始しました。
すると、CagANを用いた実験では、(大腸菌)やPseudomonas(シュードモナス属)におけるバイオフィルム形成やアミロイド様構造の蓄積が大きく減少することが明らかになったのです。
人間のアミロイド蓄積も阻害
この予想外の成果を受けて、研究チームは次に人間のアミロイドβにもCagANが作用するかどうかを検証しました。
ラボ内でアミロイドβの形成を再現し、一方のサンプルにはCagANを添加、もう一方は対照群として比較実験を行いました。
蛍光測定器や電子顕微鏡による観察の結果、CagANを添加したサンプルではアミロイドβの凝集が大幅に抑制されていたのです。
しかも、CagANの濃度が非常に低い場合でも凝集阻害効果は顕著であり、ほとんど完全にアミロイド形成をブロックしていました。
さらに、核磁気共鳴(NMR)法を使って、CagANとアミロイドβの相互作用を可視化したところ、分子レベルでタンパク質の結合を妨げている様子が明らかになりました。
さらに、CagANはアミロイドβだけでなく、タウの凝集までも同様に阻害していたことも分かりました。
つまり、アルツハイマー病に関与する2つの毒性タンパク質を同時に標的とすることが可能だということになります。
他の疾患への応用も視野に
さらに研究を進める中で、CagANが有効なのはアルツハイマー病だけではないことが分かってきました。
追加実験では、二型糖尿病に関係するIAPPタンパク質や、パーキンソン病に関与するα-シヌクレインといった、他の疾患に関係するアミロイドタンパク質の凝集も抑制していたのです。
一つの細菌タンパク質が、これほど多岐にわたる疾患関連タンパク質に作用するというのは非常に興味深い現象です。
これにより、アミロイド性疾患には共通した「クロストーク(相互作用)」のメカニズムが存在する可能性が示唆されました。
CagANはそのクロストークを遮断する鍵となり得るのです。
臨床応用には時間が必要だが、新たな可能性に期待
もちろん、今回の研究はまだ初期段階にあり、すべての実験は試験管レベルで実施されたもので、動物やヒトでの試験は行われていません。
そのため、今後は動物モデルによる再現性の確認と安全性評価が必要となります。
しかしながら、分子レベルでの作用機序の一部もすでに解明されつつあり、CagANはタンパク質の凝集を物理的に妨げるほか、初期段階のミスフォールド(折りたたみ異常)も阻害することが分かっています。
この発見はまた、長年「病原菌」として扱われてきたH. pyloriに対する見方を見直す契機にもなり得ます。
これまでは胃がんや胃潰瘍との関連から、H.ピロリを完全除菌することが目指されてきましたが、一部の研究ではH. pyloriの存在が認知症リスクと関連する可能性も報告されています。
このことから今後は、「H.ピロリをすべて排除すべきか」ではなく、「H.ピロリのどの成分が有害で、どれが有益か」を見極め、より精密で個別化されたアプローチが求められることになるでしょう。
微生物と人間との関係は、対立だけではなく、共生という新しい視点でも捉えるべき時代に入ってきているのかもしれません。
まとめ
・ヘリコバクターピロリのCagANタンパク質は、アルツハイマー病に関連するアミロイドβおよびタウの凝集を同時に阻害する可能性があると判明した
・このタンパク質は、二型糖尿病やパーキンソン病の病因となる他のアミロイドタンパク質の凝集も抑制した
・H.ピロリを「完全除去すべき病原菌」とする従来の見方に対し、より柔軟で個別化されたアプローチが必要となる可能性が発見された

















コメント