前回記事
この記事では著書「身の回りのありとあらゆるものを化学式で書いてみた」から、興味深かった内容や身の回りの物質の性質を紹介していきます。
記事を読んでいただき、少しでも世の中の見え方が彩り豊かになってくれたら幸いです。
さて前回記事では石油とガソリンについての話をましてきました。
ガソリンで走らせるものに必要なものといえば、タイヤですね。
今回はタイヤの主な構成成分である、“ゴム”についての化学です。
ポリイソプレン
ゴムを構成する分子はある分子がいくつも繋がって大きくなったものです。
ゴムを構成する物質にはたくさんの種類がありますが、中でも有名なものの一つとしてはポリイソプレンが挙げられます。
イソプレンという構造にポリ(沢山)という意味の言葉がついた物質です。
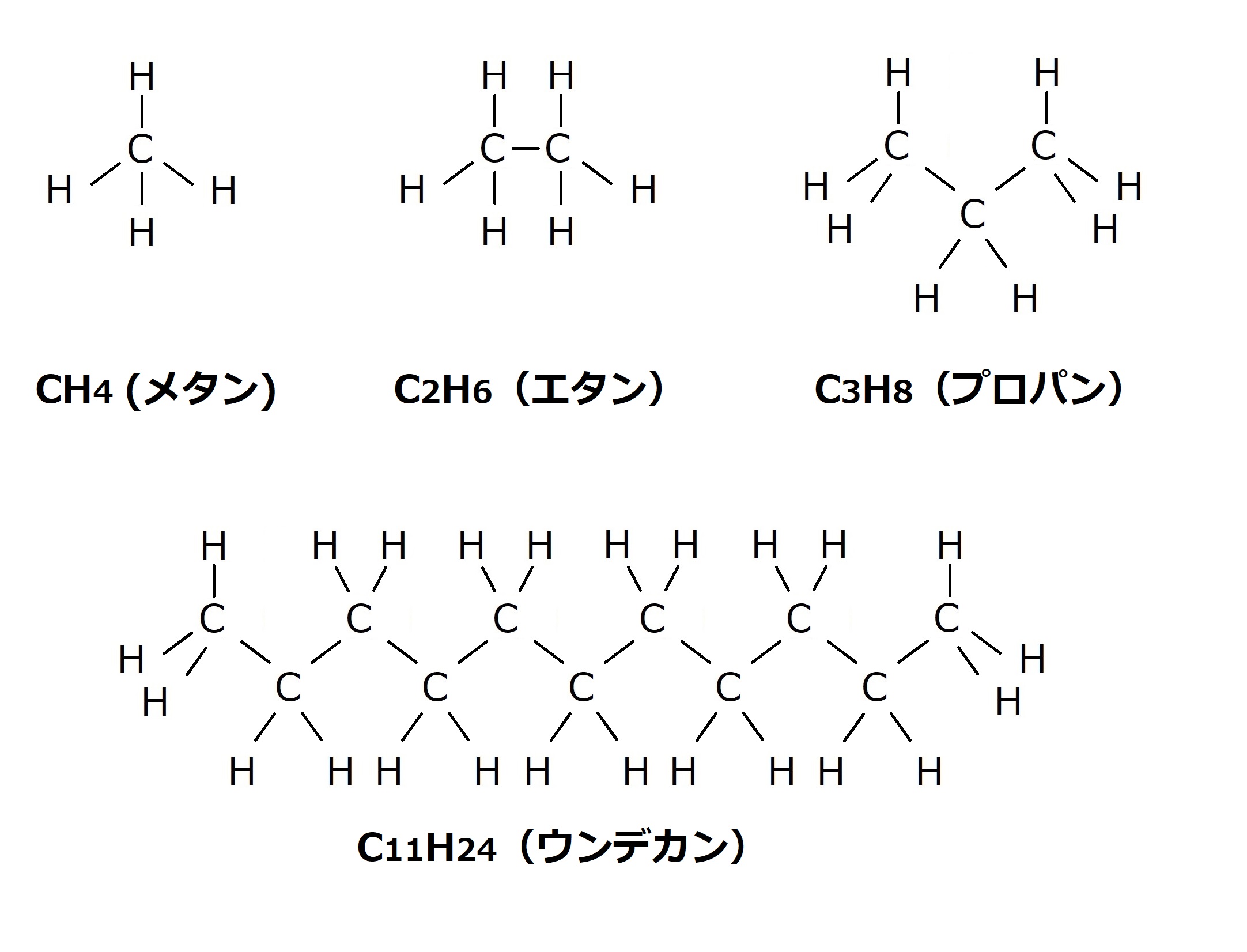
イソプレンはこのように水素と炭素が繋がった構造をしています。
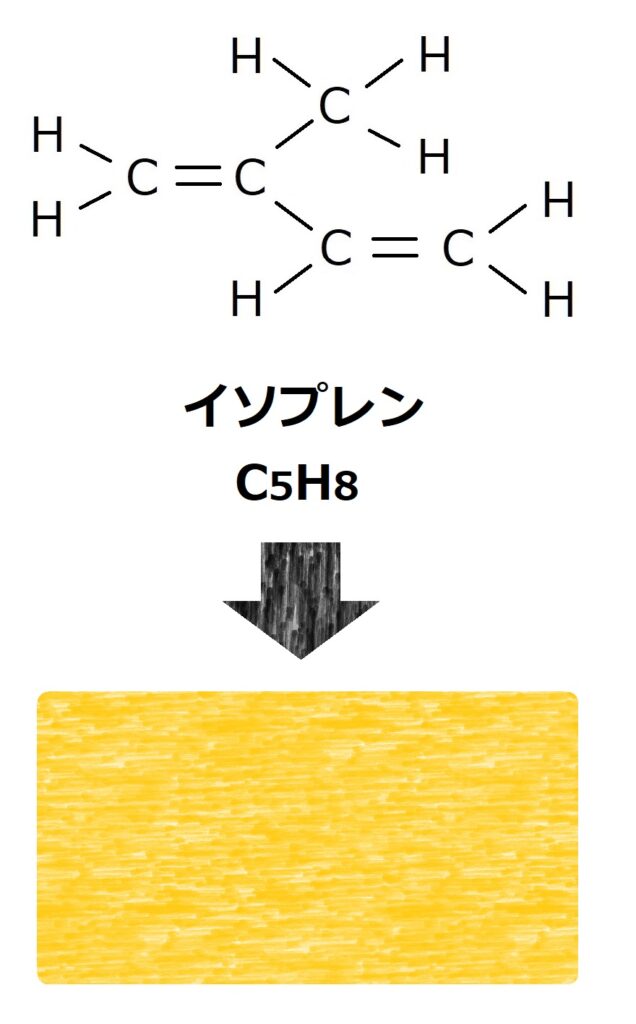
分かりやすいように四角い図形に変えて説明していきます。
イソプレンは石油から得られるナフサにさらに熱をかけて作ることができます。
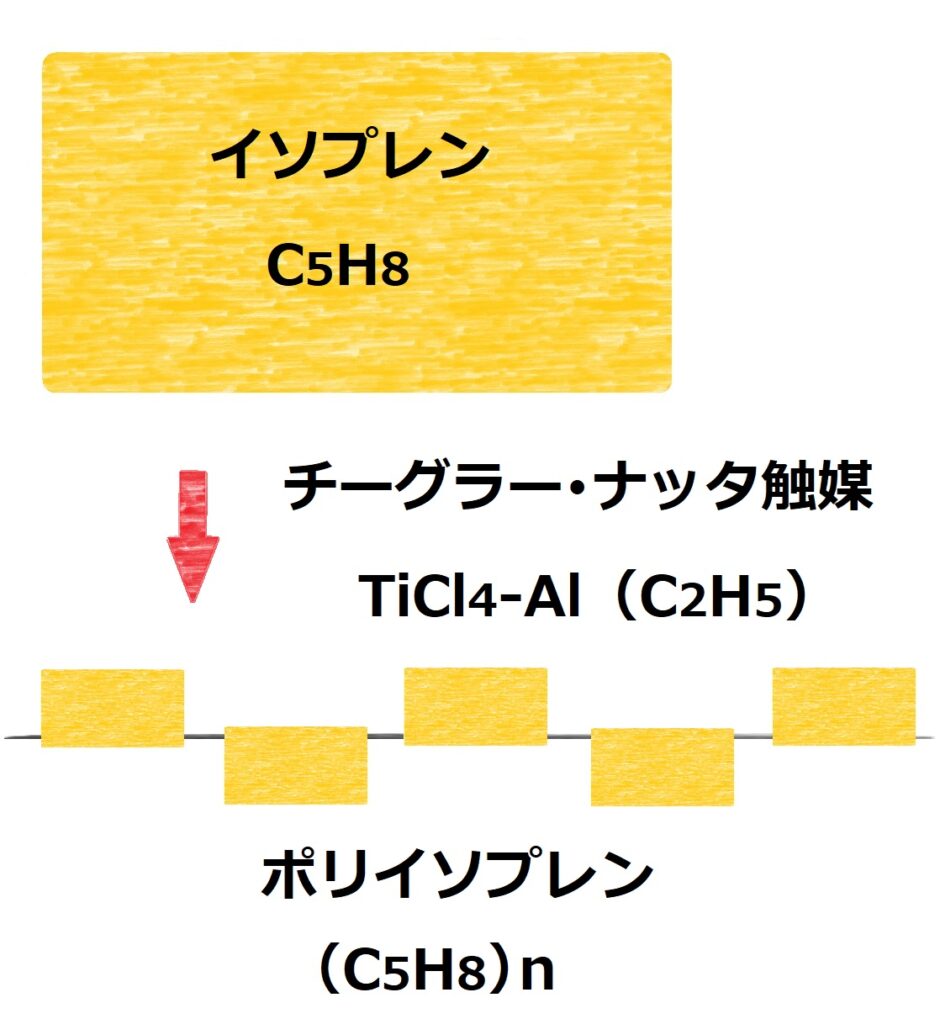
この分子を化学反応により人工的につなげていくとポリイソプレンが出来上がります。
ポリイソプレンの化学式は(C5H8)nです。
nはいくつも繋がったという意味だと思ってください。
ポリイソプレンの繋がり方によってゴムのような弾力性があるものになったり、プラスチックのよう硬い分子になったりします。(この後すぐ説明します。)
ゴムの弾力の仕組み
通常の天然ゴムを作る場合は、ゴムの木の樹皮から粘性のある液体(ラテックス)を採り、酢酸などを加えてゴムを得ることができます。
タイヤのような弾力と強度に富んだゴムを作るにはチーグラー・ナッタ触媒TiCl4-Al(C2H5)が必要になります。
触媒は酵素のように反応を手助けしてくれるものです。
今回はポリイソプレンの繋がり方を手助けしてくれる存在だとしておきます。
ではなぜ分子の並び方の違いによって、弾力性がある場合と硬くなってしまう場合があるのでしょうか。
それはイソプレンの繋がり方にヒントが隠されています。
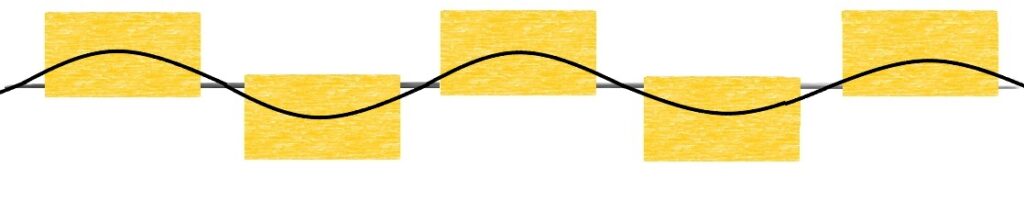
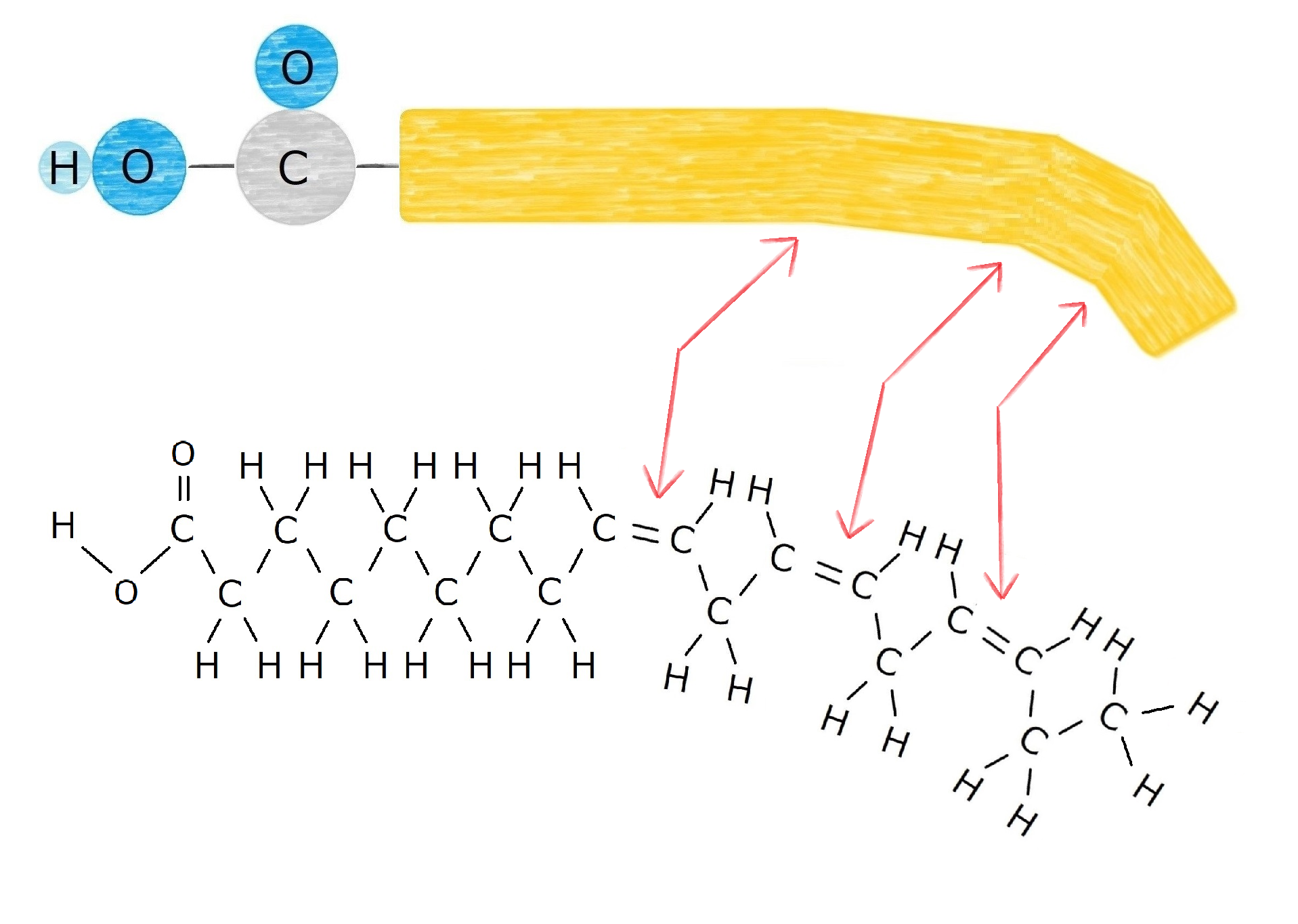
ゴムになる場合の図では、ポリイソプレンが波打ちながら繋がっていることが分かります。
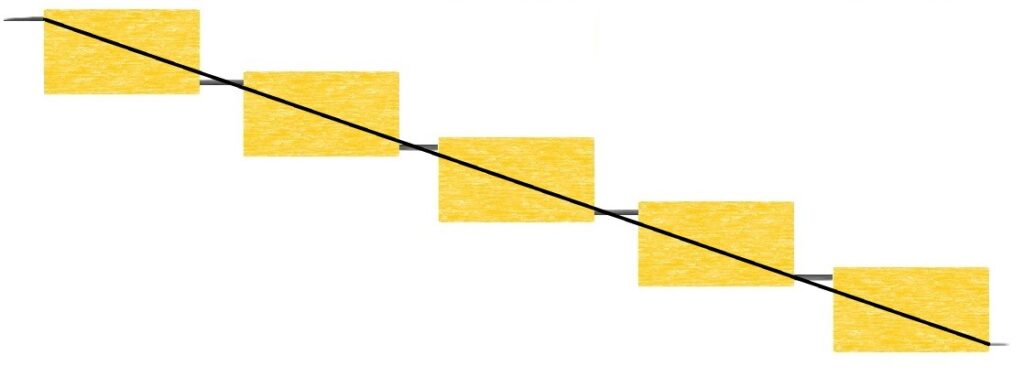
対して、硬くなる場合の図では、ポリイソプレンが直線的に繋がっていることが分かります。
このふたつが集まったものが以下の図です。

並べ方の違いによってゴムっぽいのか、プラスチックっぽいのかが変わるのですね。
タイヤで使う際にはもちろん波打った方のポリイソプレンを使いますが、それだけではまだ私たちが思ったよりほどの弾力は得られていません。
過去に硫黄の元素紹介でも少し触れましたが、ゴムの分子に少量(ゴムに対して5~8%)の硫黄を加えることで弾力を増すことができます。
硫黄を加えるとゴムの分子間に網目状の構造ができるため、伸び縮みする能力が高まるのです。
ちなみにこの状態で筒状に型取りし、輪切りにすると輪ゴムになります。

最後に話をタイヤに戻しますと、タイヤにはポリイソプレン以外の分子も含まれています。
その中でも有名な分子にスチレン-ブタジエン-ラバー(SBR)があります。
その名の通り、スチレン(C8H8)とブタジエン(C4H6)が繋がった分子です。

強度、弾力、対摩耗性に優れているため、タイヤのトレッド(タイヤが路面と接触する部分)に使われています。
また、ゴムの強力さを増すためにカーボンブラックも含めたりします。
カーボンブラックは石油を蒸留した後に残ったものから作られる煤(スス)のことで、成分の95%以上が炭素です。
そんなところにも石油が使われているのですね。
まとめ
いかがだったでしょうか、タイヤとゴムの科学。
今回は化学的な反応を助ける要素として熱や時間、酵素の他に触媒が出てきましたね。
触媒は19世紀に活躍した科学者のヨハン・デベライナーやイェン・ベルセリウスらによって明らかになっていった仕組みです。
記事内で紹介したチーグラー・ナッタ触媒は、チタンとアルミニウムを含んだ薬品です。
この触媒の発見は非常に高く評価され、1963年には開発者であるカール・チーグラー教授らに対してノーベル賞が送られています。
次回記事
関連記事





















コメント