前回記事
現在記事の主なテーマである身近な化学。
今回から電池について触れていくことになりますが、電池を説明するにあたって関係ある人物とその功績を紹介しようと思います。
その人物はジョン・フレデリック・ダニエルです。
アレッサンドロ・ボルタに続き電池に深い関わりのある人物です。
電池を発明したのがボルタであれば、実用化し世界に広めたのはダニエルと言えます。
また彼の発明も素晴らしい科学的なアイデアが詰まったものです。
彼の発明であるダニエル電池について仕組みも併せて見ていきます。
ジョン・フレデリック・ダニエル

イギリスの科学者ジョン・フレデリック・ダニエルは、初めて安定した直流電流を供給できる電源(一次電池)を発明した人物でもあります。
1970年、ロンドンに生まれたダニエルは幼い頃から教育に恵まれ古典学を主に勉強していました。
生計を立て始める頃には親戚が経営する砂糖精製工場で働いていた彼ですが、やがてかねてから興味があった科学の世界に身を置くことになります。
研究生活に身を置き始めたダニエルは王立研究所化学教授ブランドに出会います。
彼らは良き友となり、科学研究の旅に出たり研究所の雑誌復刊の為に尽力しました。
1831年にはキングスカレッジの初代化学教授に任命され、当時の最先端の科学の一翼を担っていました。
その頃巷を騒がせていたのは、アレッサンドロ・ボルタが発明したボルタ電池でした。

ボルタは自身の発明した電堆をさらに改良し、“ボルタ電池”として発表し注目を浴びていました。(1800年頃)
しかし、ボルタ電池には電力を発生させた後に起電力がすぐになくなってしまう欠点がありました。(起電力=電流を生じさせる電位差=電流を流し続けようとする力)
この問題を解決すべく、ダニエルは研究を重ねることになります。
ボルタ電池とダニエル電池
ボルタ電池は希硫酸の中に亜鉛版(-極)と銅板(+極)を入れて電子の交換を行うことで電流を発生させます。
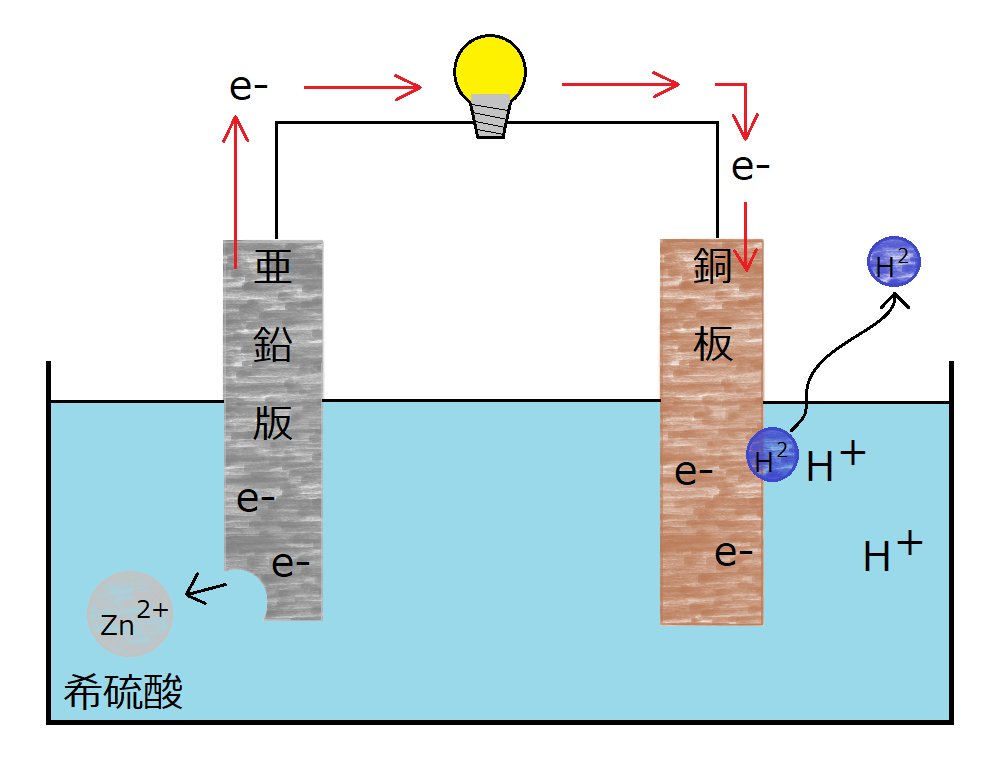
一見単純で無駄のないシステムに見えるボルタ電池ですが、やはりどうしても起電力が急激に少なくなってしまいます。
この欠点を克服しなければ長時間電力を供給することができず、実用化するには少し問題が大きい発明になってしまいます。
しかしダニエルは起電力の消失は銅板に発生する水素が原因であることを突き止めました。
発生した水素が銅板にまとわりつき、電子のやり取りの邪魔をしていたのです。
そこでダニエルは素焼き板を使うことにしました。
溶液を分断するように素焼きの板を入れ、それぞれの溶液を硫酸亜鉛水溶液と硫酸銅水溶液に変更した電池を考えました。
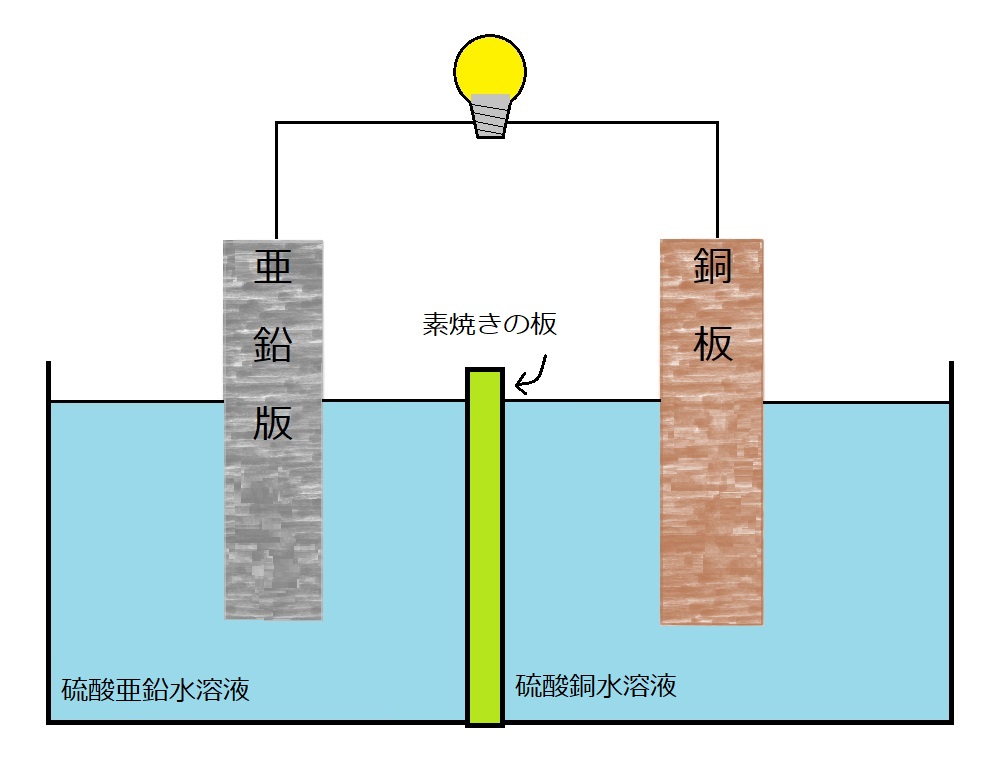
素焼きの板には小さな穴が開いており、大きな粒子は通さず小さな粒子(イオン)のみ通す役割があります。
これがいわゆるダニエル電池です。
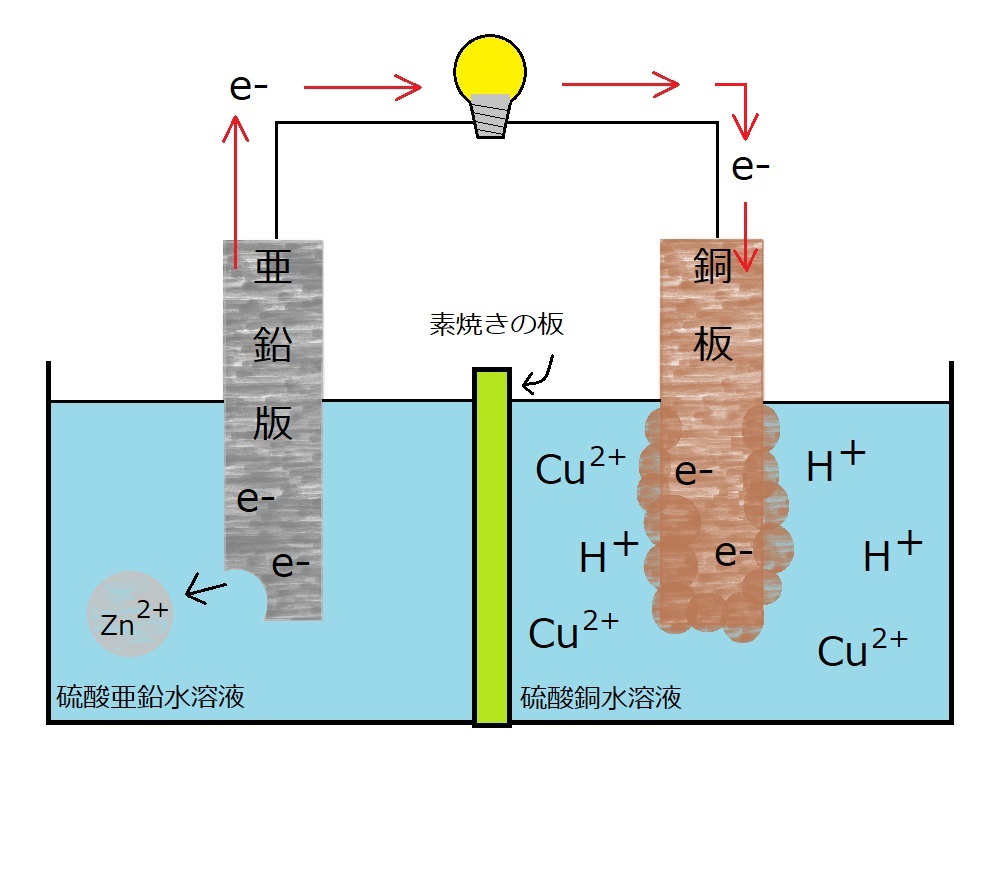
ダニエル電池の反応を見てみると、-極である亜鉛版の反応はあまり変わりませんが、+極である銅板では水素が発生せず、問題点だった泡の発生を防ぐことができました。
これによって電子の動きが邪魔されなくなりよりボルタ電池をはるかにしのぐ持続性を手に入れる実用化につなげることができました。
水素が発生しない理由と素焼き版の役割
-1.jpg)
水素が発生しない理由は、電子(e-)が銅板に移動した際に、水素イオン(H+)ではなく銅イオン(Cu2+)と引き合うからです。
これにはイオン化傾向が関係しています。
イオン化傾向はCu<Hです。
つまり水素の方がイオン化しやすいため、水素イオンとして溶液中に残ります。
対して銅はイオン化しにくい=単体の状態に戻りたいということになり、+極に析出していくのです。
・追記
【ともけむさんからの指摘】
上記のイオン化傾向と銅の析出の内容について、大学受験化学予備校の講師の友けむさんからご指摘いただきました!
内容を比べるため、あえて元の分は残しつつ、訂正内容のリプライをそのまま追記させていただきます。

しかしこのままでは銅板の溶液の+イオンが減り続け、電池としての機能を失ってしまいます。
その時に役立つのが素焼きの板なのです。
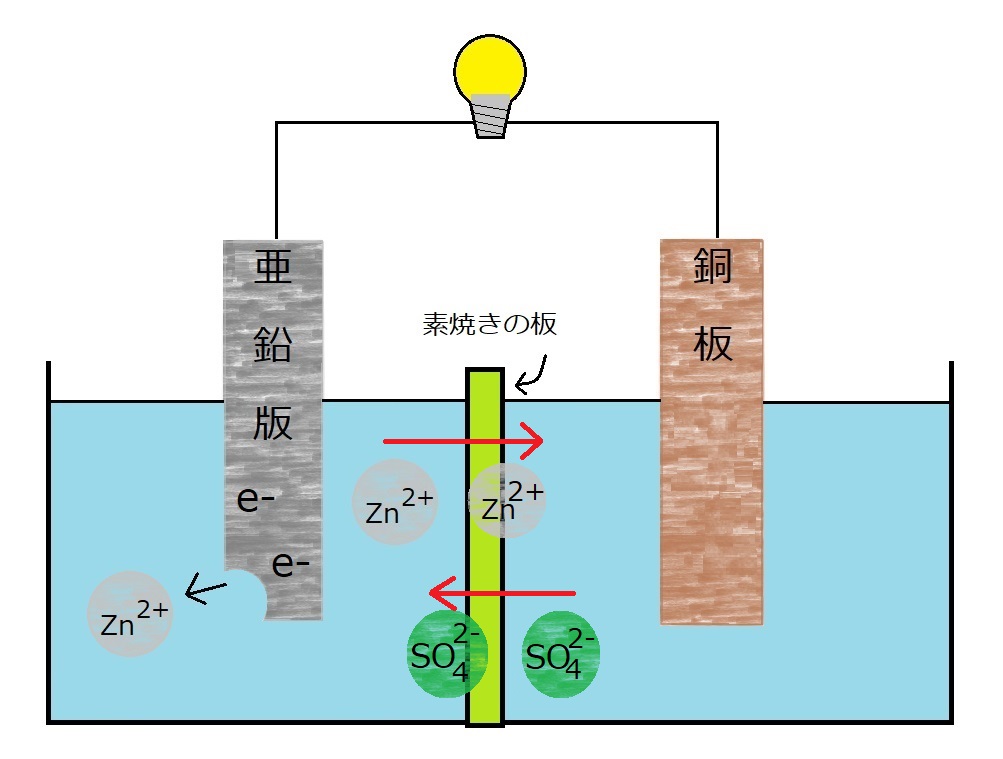
図を見てみると、陽子(+イオン)のバランスを保つために、硫酸亜鉛水溶液中から亜鉛イオン(Zn2+)が素焼き版の穴を通って→に移動します。
また、電子(-イオン)が少なくなった分は硫酸銅水溶液から硫酸イオン(SO4*2-)が←に移動します。
こうしてイオンのバランスを保ち、電池として長く機能する状態を作りだしたのです。
ちなみに上で紹介したようなダニエル電池の起電力は1.1Vと決まっていますが、これは電位差の数値が化学的に決まっているからです。

表を見ると、銅の電位は+0.337、亜鉛の-0.763となっています。
起電力は電流を生じさせる電位差なので差を求めると……。
0.337-(-0.763)=1.1V
となりピッタリ計算が合いますね!
まとめ

以上、フレデリック・ダニエルと彼が発明したダニエル電池の仕組みについてでした!
ダニエルがダニエル電池を発明したのは1836年頃のことなので、かなりの試行錯誤ああったことが分かります。
彼はここにたどり着くまでに銅と亜鉛からなる熱電対(温度計)も発明したりと、生涯のほとんどを研究に捧げていました。
彼は1845年3月13日、研王立協会の会合中に死去したとされています。
彼は死の間際まで化学の世界に身を置く研究者だったのですね。
またひとつ電池に知識の色が付きました。
追記(2022/10/26)
記事の内容に指摘をいただいたので追記更新します!
↓

指摘していただいたのは大学受験化学予備校の講師であるともけむ@blogさん!
陽極側に水素が発生しない理由は、イオン化傾向の要因よりは、そもそも硫酸銅水溶液中に水素イオン自体が少ないという要因の方が大きいことをご指摘いただきました!
記事のもともとの文は残しつつ、指摘のやり取りについて注釈の形で入れさせていただきます。
併せて図も訂正させていただきます。
【訂正前】
【訂正後】
.jpg)
訂正ありがとうございました!
またリプライのスクショの使用も許可していただき大変助かりました!
次回記事


コメント