水素、ヘリウム、酸素に次いで、宇宙の多く存在する元素が炭素です。
炭素化合物の種類は元素の中で最も多く、タンパク質、脂質、炭水化物など生物の構成材料にもなっています。
自然界では、植物のよる光合成によって、水と二酸化炭素からこれらの有機化合物が作られます。
こうしてつくられた炭素は生物の体を構成し、生物としての役目を終えると長い年月をかけて石油や石炭、天然ガスなどの資源(化石燃料)になるとされています。
ダイヤモンドと黒鉛の違い
炭素はその名の通り、炭を構成している元素でもあります。
黒鉛(グラファイト)やダイヤモンドはいずれも同じ炭素からできていますが、原子の配列や結合の仕方によって特徴が異なるものができ、これを同素体と呼んでいます。
以前、別の記事にて紹介した内容を参考にまとめていきます。

これは炭素原子と価電子のイメージ図です。
赤い丸は他の炭素と結びつくことができる腕だと思ってください。
炭素には4本の腕があります。
腕にはくっつく力や電気を通す力があります。
【ダイヤモンド】

ダイヤモンドは炭素が立体的に結合した姿です。
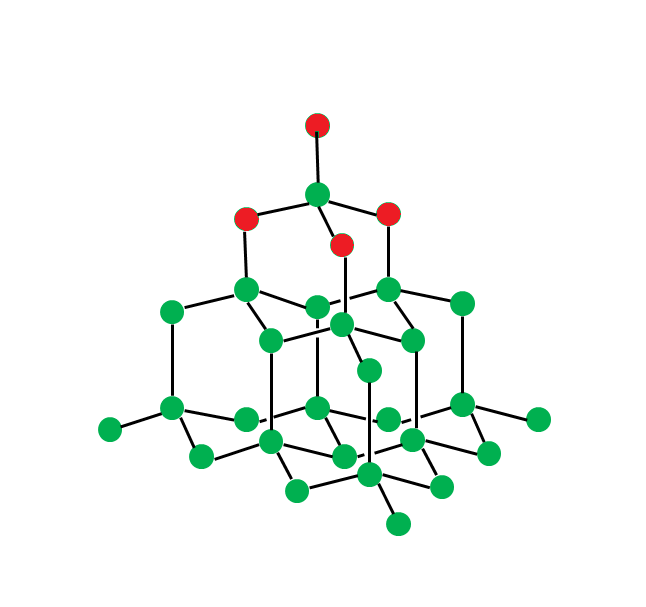
炭素が持つ4つの腕全てを使ってがっしり結びついています。(共有結合)
これによって非常に硬い特徴を持ちます。
また全ての腕を結びつきに使い、電気を通すための腕がないため、電気を通さないという特徴も持ちます。
共有結合でできた結晶は以下のような特徴を持つものが多いです。
・電気を通さない
・水に溶けにくい
・融点が高い
・硬い
【黒鉛(グラファイト)】

黒鉛(グラファイト)は4本のうち3つの腕を使ってくっついています。
ダイヤモンドは4つの腕全てを使って立体の形をとることができますが、グラファイトは3つの腕しか使っていないので、平面の構造しかとることができません。
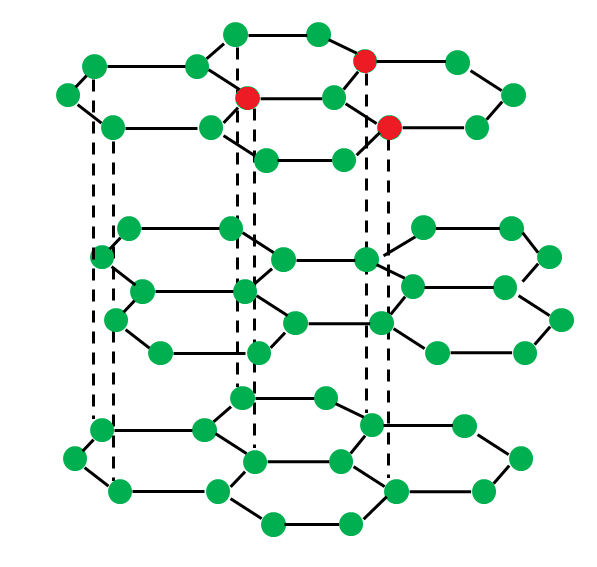
なので下敷きや紙のような平面の形をとります。
ではなぜ腕を使っていないのに元素(分子)同士がくっついているのでしょうか…?
下敷きをガラスなどに隙間なく押し付けたりすると、接着剤などはないのにくっつくような現象を見たことがあると思います?
この物質同士の吸着現象は分子間力が原因となっています。(分子間力=分子の間にはたらく弱い引力)
静電気によって髪の毛が吸い付いたり、サランラップが食器などにくっつくのも、この分子間力が原因です。
実は黒鉛同士もこれと同じ要領でくっついています。
しかし分子間力は力が弱いため、外部からの力ですぐに離れてしまいます。
黒鉛はの構造を見ると、横の繋がりは強いですが縦の繋がりは弱いです。
これによって鉛筆の芯にちょっとの力をかけだけで黒鉛が崩れ、字が書けるようになっています。

コメント