この記事では著書「身の回りのありとあらゆるものを化学式で書いてみた」から、興味深かった内容や身の回りの物質の性質を紹介していきます。
今回取り上げるテーマは“塩”です。

保存食や料理の味付け、人の体では細胞に酸素や栄養を運ぶなど様々な役割を持つ塩。
塩といえば中学理科でお馴染みのNaCl(塩化ナトリウム)が思い浮かびます。
当時は目に見えないものをアルファベットを使ってイメージすることができず、かなり苦手な分野でした。
特に塩を水に入れると電離をするという基本的な仕組みが全く理解できず、その時点で授業につまずいていました。
今回の話はそんな塩と水の関係についてです。
塩化ナトリウム
一般的に塩の化学式はNaClです。
上の図のように、ナトリウム原子Naと塩素原子Clが1:1の関係で規則的に色んなものが繋がっています。

原子を模式的に表した円の中には、NaではなくNa+、 Clではなく Cl-と表されていますね。
+の記号はプラスの電気を、−の記号はマイナスの電気を帯びていることを表しています。
このプラスやマイナスの電気を帯びているものを“イオン”と言います。
今回の場合はNa+がナトリウムイオン、 Cl-が塩化物イオン(塩素イオンではない)です。
それぞれ電気的な力によって引き合っているということですね。
そんな気の合う仲間同士で塊を作る塩化ナトリウムですが、水に入れると簡単にバラバラになってしまいます。
ではなぜ結合が解けてしまうのか……。
どうやら水の性質に答えがあるようです。
塩が水に溶ける仕組み
上で説明した電気的な性質がイメージできるようになったことで、水に溶ける仕組みが分かってきます。
水は1つの酸素原子Oに2つの水素原子HがくっついたH2Oとして存在しています。
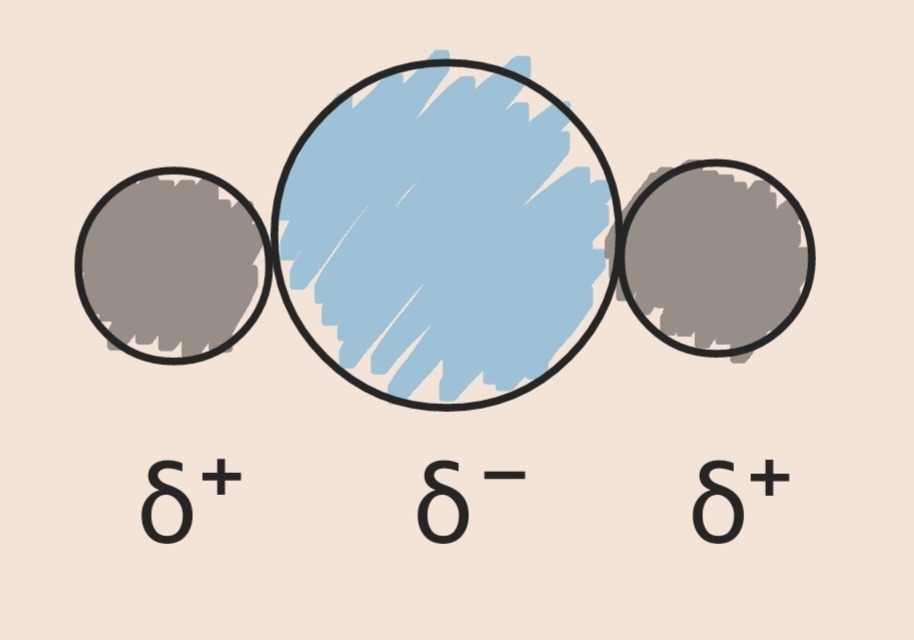
水はイオンではありませんが、少しだけ電気を帯びています。
上の図では、この少しだけを表す記号としてδ(デルタ)を使ってH2Oを表しています。
酸素原子にはδ−の性質が、水素原子にはδ+の性質があることを示しました。
さて、ちょっと電気を帯びている水(H2O)の中に塩(NaCl)を入れるとどうなるのでしょう?
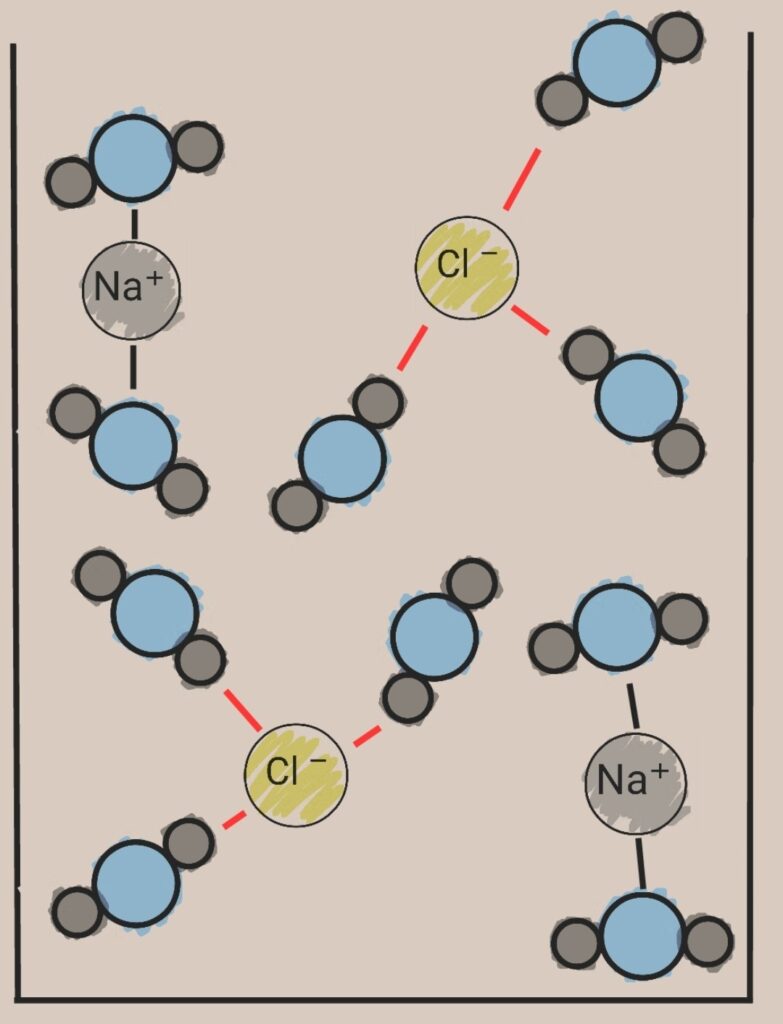
少し雑な図ですが、Na+の周りにはO(δ-)が、Cl-の周りにはH(δ+)がまとわりついています。
つまりナトリウムイオンは酸素原子の影響を受け、塩化物イオンは水素の影響を受け、簡単にバラバラになってしまうのです。
こうやって塩が水に溶けることを説明することができるのですね!
塩を使って保存

この作用を利用して作られる身近な食品が、ピクルスや梅干しなど塩漬けをする保存食です。
先ほどは水の作用によって塩がバラバラになってしまうことを説明しました。
逆に言えば塩は水を引き寄せる作用があるとも言えます。
長期保存の鍵はいかに腐らせないかです。
食品が腐る原因は微生物が大量に増えることが原因です。
微生物が増えるためには水が必要になります。
食品の水分と塩を引き合わせることで、微生物が増えるために必要な水分をなくすことができます。
これが塩漬けの原理なのですね。
まとめ
いかがだったでしょうか塩の化学。
中高で習う化学の復習にもなる内容でしたね!
歴史を遡ってみると、古代エジプトやメソポタミア文明の頃から塩産業が盛んであったことが分かっています。
特に古代エジプトではミイラを保存するための物質にナトロン(塩の混合物)が使われていました。
他にも没薬などの科学的な作用で死んだ人間を保存していたとされていますが、人を塩漬けにするという発想に行き着くのがまた人類の面白いところですね。
次回記事

コメント